Актуальность
В настоящее время клинические исследования сконцентрированы на ишемической болезни сердца [1, 2, 3], поскольку данное заболевание превалирует в структуре смертности и летальности. В то же время патогенетические исследования, и в том числе фармакотерапевтические изыскания, посвящаются дезинтоксикации [4, 5] организма.
Однако воспаление как ведущий патогенетический процесс остается в стороне от основных векторов развития медицинской и биологической науки. Ранее осуществлялись попытки моделировать воспалительный процесс на макете регенерации поджелудочной железы, при введении в ее ткань диспергированных биоматериалов [6]. Эти работы не получили дальнейшего развития в силу отсутствия протекционизма в этой области исследований. Хотя имеются сообщения из клиники Шалимова А.А. (1975) о лечении хронического панкреатита инъекционным способом [6].
Исследование генетических маркеров, обуславливающих хронизацию воспаления, не дало каких-либо ощутимых результатов в клиническом применении.
Псевдонаучные дискуссии о первичности эпителия или стромы давно канули в лету, однако эволюционно обусловленные процессы регенерации, когда при восстановлении разрушенных тканей область рубца заполняется соединительной тканью, до сих пор вызывает некоторое недоумение. Поскольку у рептилий имеются механизмы полноценной реституции.
Филогенетически наиболее примитивной тканью, доступной для исследования в человеческом организме, на наш взгляд, является толстокишечный эпителий. В этой связи нами проведено исследование возможностей коррекции эпителиально-стромальных взаимоотношений в анокопчиковой области, в частности, у больных с хроническими свищами прямой кишки.
В этой области, как известно, обитают наиболее примитивные формы микроорганизмов, симбионтов и антагонистов макроорганизма, поэтому воспалительный процесс характеризуется своими особенностями, то есть склонностью к хронизации и преобладанием склеротических явлений [6,7].
В качестве препарата, позволяющего модифицировать апоптоз, был взят диспергированный биоматериал, более известный под маркой «Аллоплант». Проведённые нами ранее исследования показали возможность изменения направления регенерации при использовании данного препарата [8]. В то же время оставалась возможность того, что плацебо также обладает подобным эффектом, кроме того, сама по себе инъекция в зоне хронического воспаления, возможно, обладает неким разрыхляющим эффектом, канализацией, что, вполне возможно, приводит к терапевтическому воздействию.
Цель исследования. Изучить параметры регенерации в условиях хронического воспаления у проктологических больных в условиях раннего послеоперационного периода.
Материал исследования
У двух пациентов, оперированных по поводу эпителиального копчикового хода и параректального свища, с их добровольного согласия были взяты биопсийные материалы. Во время операции в обоих случаях было произведено обкалывание области хронического гнойника диспергированным биоматериалом. После выполнения основного, традиционного этапа оперативного вмешательства, производилось обкалывание 4–6 точек, на расстоянии 0,5 см от края послеоперационной раны. В каждую точку на середину глубины послеоперационной раны вводили 0,5 мл диспергированного биоматериала («Стимулятор регенерации»), разведенного 2,0 % раствором лидокаина. Введение осуществлялось исходя из ранее эмпирически полученных данных, что инфильтрация раствором препарата приводит к его распространению от точки вкола в среднем до 5 мм по радиусу.
Возраст больных был 34 и 39 лет, то есть трудоспособный. Оба пациента были мужчинами.
Методы исследования
Иммуногистохимическим способом выявляли степень уровней экспрессии в тканях: 1) основной фактор роста фибробластов и его рецептора;
2) ядерный антиген пролиферирующих клеток;
3) ферменты, родственные цистеиновым протеиназам, CPP32.
С этой целью применён набор с моно- и поликлональными антителами (Immuno Cruz Staining System) фирмы Santa Cruz Biotechnology, Inc.
Результаты. После проведения операции по поводу эпителиального копчикового хода и хронического свища прямой кишки больным был введен диспергированный биоматериал. В послеоперационном периоде на 2-е, 4-е, 6-е, 8-е, 10-е и 14-и сутки бралась биопсия. Исследовалась гистологическая динамика регенерации гнойной раны. Как отмечалось выше, забор биопсийного материала брался с согласия больных, оперированных по поводу эпителиального копчикового хода и параректального свища. У больных, которые были оперированы по поводу анальной трещины, биопсийный материал из анального канала не брался, в связи с риском возникновения осложнений после данной манипуляции.
Традиционные хирургические методы лечения проктологических заболеваний, сопровождающихся хроническими воспалительными реакциями, в большинстве ситуаций никак не влияют на дисрегенераторные процессы, в результате возникает нарушение трафика воспалительно-репаративных реакций, что не способствовало нормализации сроков заживления гнойных ран.
На наш взгляд, изначально полиморфно-ядерные лейкоциты включались в процесс малоэффективно, что в последующем привело к значительной стагнации миграции моноцитов и коллапсу содержания макрофагов в зоне репарации. Это в свою очередь рождало несовершенный фибриллогенез, формирование неполноценной грануляционной ткани. Далее каскадно следовал самопроизвольный некроз тканей, но более важными были патологические коннотации эпителиально-стромальных взаимоотношений.
Как результат этого процесса, в биопсийном материале выявлялась грубо оформленная слабо васкулизированная соединительная ткань, она была покрыта атрофичным истонченным многослойным плоским эпителием. По краю рубца отмечался очаговый периваскулярный отек и слабая лимфоидная инфильтрация [8].
Гистологическая картина биопсийного материала после введения биоматериала выглядела, как описано ниже.
На 2-е сутки после введения наблюдался существенный коллапс воспалительных инфильтратов, преимущественно за счет резкого падения содержания нейтрофилов. В отдельных полях зрения отмечался умеренный инфильтрат, состоящий из полиморфно-ядерных лейкоцитов. Кроме того, в значительном количестве присутствовала эозинофиолия, а также моноциты.
4-е сутки. В отличие от обычного заживления гнойной раны, в наших наблюдениях уже на 4-е сутки активировались фибробласты, последние лизировали коллаген.
6-е сутки. Все обследованные материалы показали наличие зрелой грануляции с вертикально расположенными сосудами, прогностически положительным моментом было наличие базальных мембран.
В 90 процентах случаев на 8-е сутки послеоперационного периода визуализировались закладки эпителия в виде слоеного пирога, с дифференцировкой по плоскоклеточному типу. При этом отмечалась высокая степень развития сосудов соединительной ткани.
На 10-е сутки, в зоне послеоперационного рубца, наблюдали явления среднего акантоза кожного эпителия, в котором были видны сосочковый и ретикулярные слои.
При исследовании в отдаленном послеоперационном периоде (полгода) в крестцово-копчиковой области определяли сформированность многослойного плоского ороговевающего эпителия с низким акантозом и нормальной конфигурацией коллагена в сосочковом слое кожи. А в перианальной области выявили многослойный плоский ороговевающий эпителий со средним акантозом и низким уровнем склеротических процессов сетчатого слоя кожи.
Иммуногистохимическое исследование биопсийного материала в динамике после введения биоматериала установило следующие закономерности.
Впервые 2-е суток основной фактор роста фибробластов экспрессировался преимущественно гранулоцитами. Максимальногоуровня экспрессия основного фактора роста фибробластов достигала на 6-е сутки лечения, при этом ведущий процесс выполняли макрофаги и фибробластоподобные клетки (рис. 1).
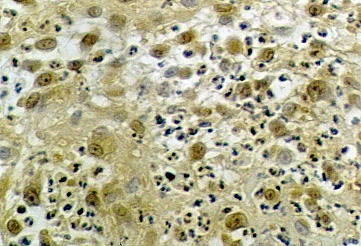
Рис. 1. Экспрессия основного фактора роста фибробластов на 6-е сутки после введения диспергированного биоматериала. Непрямой иммуноферментный метод с пероксидазой. х200
14-е сутки. Основной фактор роста фибробластов содержали только эндотелиальные клетки новообразованных сосудов дермы. Точно такая же динамика и локализация экспрессии рецептора, основного фактора роста фибробластов. Начиная с 10-х суток, локализация рецептора была преимущественно в эндотелии новообразованных сосудов дермы (рис. 2).
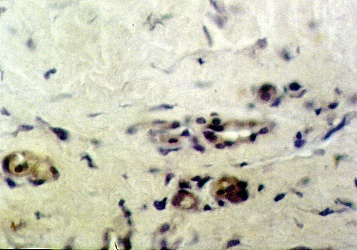
Рис. 2. Экспрессия рецепторов к bFGF на 6-е сутки после введения диспергированного биоматериала. Непрямой иммуноферментный метод с пероксидазой. х200
Максимальный уровень пролиферации и апоптоза достигался на 6-е сутки, при этом наибольшим пролиферативным потенциалом обладали эндотелиоциты грануляционной ткани (рис. 3).
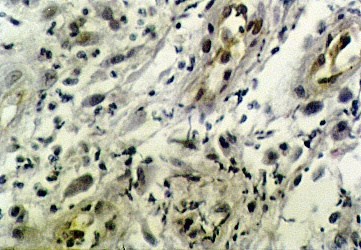
Рис. 3. Экспрессия PCNA на 6-е сутки после введения диспергированного биоматериала. Непрямой иммуноферментный метод с пероксидазой. х200
А интенсивный апоптоз происходил как в эндотелиоцитах грануляционной ткани, так и в фибробластах стромы (рис. 4).
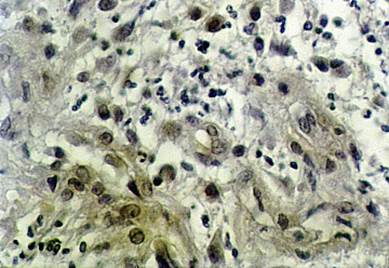
Рис. 4. Экспрессия CPP32 на 6-е сутки после введения диспергированного биоматериала. Непрямой иммуноферментный метод с пероксидазой. х200
Таким образом, использование биоматериала обеспечивало резкое снижение активности воспаления и усиливало миграцию моноцитов в зону послеоперационной раны. В последующем происходила дифференцировка моноцитов в макрофагально-фибробластический ряд. При этом согласовывались по времени выделение основного фактора роста фибробластов и его рецептора, что обеспечивало полноценность межклеточной кооперации. Применение индукции апоптоза усиливало разрастание и апоптоз эндотелия, что помогало росту грануляций. Наряду с этим отмечалась активация фибробластов в грануляционной среде, что приводило к тому, что грубая рубцовая ткань не образовывалась. Таким образом, уменьшались сроки послеоперационного периода и время заживления гнойных ран у исследуемых больных [8].
Однако, по нашему мнению, коррекция эпителиально-стромальных взаимоотношений происходит не только и не столько под влиянием характера вводимого биоматериала, но и самого процесса введения, то есть на эпителиально-стромальные взаимоотношения влияют уровень и степень хирургической агрессии.
