Высокая реакционная способность аскорбиновой кислоты (АК) является причиной существующей проблемы сохранности этого витамина в растительных извлечениях, включая фруктовые и овощные соки. Факторами, определяющими устойчивость АК в растительных извлечениях, являются: ионы металлов (II), координационные соединения которых с АК разлагаются быстрее свободной АК; водородный показатель (рН), обеспечивающий образование устойчивого однозарядного аниона АК (4,5-8,0) или неустойчивого двухзарядного аниона АК (8,0<рН<4,5); различные окислители АК, прежде всего, молекулярный кислород воздуха [1].
Действие стабилизаторов АК в растительных извлечениях (в первом приближении водных растворах) направлено на благоприятное влияние выше указанных факторов. К их числу относятся органические кислоты, соли, углеводы, спирты, флавоноиды и др. [2], из которых предпочтение отдается щавелевой кислоте (ЩК) по причинам: образования с ионами металлов прочных комплексов; стабилизации АК в разбавленных растворах (10-3 г/мл); исключения сильнокислой среды; относительно продолжительной стабилизации (до 4 суток) [2].
Наше внимание привлек факт, что при наличии пектинов (0,7-2,7%) во фруктовых соках, соки характеризуются относительно высоким содержанием АК (1,0-8,0 мг%) [3]. Однако содержащиеся в растениях пектины связаны с металлами, флавоноидами [4], что, по-видимому, ограничивает их благоприятствующее влияние. Наряду с этим, при отжиме соков в них переходят низкоэтерифицированные и низкомолекулярные пектины [4]. Учитывая физико-химические свойства пектинов [4, 5], они вполне могли бы обусловить благоприятное действие на выше перечисленные факторы устойчивости АК в соках и, наряду с этим, оказать лечебно-профилактическое влияние [6], не нарушая баланса жизненно важных микроэлементов [4] в организме человека. Кроме того, многие соки характеризуются содержанием АК менее 10-3 г/мл (10-6-10-4 г/мл), при котором процесс разрушения АК идет быстрее и глубже, чем в концентрированных растворах [3], что побудило нас именно в этих пределах концентраций АК исследовать влияние пектинов.
Цель исследования - изучение возможности применения очищенных пектинов, в сравнении с ЩК, для стабилизации АК в разбавленных водных растворах или соках-фреш с концентрацией 1·10-6 - 1·10-4 г/мл.
Задачи исследования:
- изучение влияния пектинов на светопоглощение АК в УФ области спектра при использовании дифференциальной спектроскопии;
- определение удельного показателя поглощения (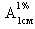 ) АК для контроля количественного содержания АК в модельных смесях со вспомогательными веществами;
) АК для контроля количественного содержания АК в модельных смесях со вспомогательными веществами;
- выбор оптимального стабилизатора и его дозы по количественному содержанию АК в модельных смесях со вспомогательными веществами в процессе хранения;
- экспериментальное определение концентрации АК в соках для их купажирования выбранным вспомогательным веществом;
- сравнение соков до и после купажирования вспомогательным веществом по физико-химическим показателям (рН, приведенной вязкости) и срокам хранения.
Материалы и методы исследования
В качестве материалов исследования использованы: АК, ЩК, свекловичный (СП), цитрусовый (ЦП) и яблочный (ЯП) пектины, соответствующие по качеству фармакопейным требованиям [7]. Указанные пектины очищены от минеральных элементов, флавоноидов известным способом [4]: экстракцией цитратом аммония, диализом через мембрану, обработкой аммиаком, соляной кислотой, выделением спиртом. Очищенные пектины характеризовались средней молярной массой (кг/моль): СП – 61000, ЦП – 66000, ЯП – 87500; содержанием свободных карбоксильных групп (%): СП – 19,1, ЦП – 18,1, ЯП – 17,0; степенью этерификации (%): СП – 46,5, ЦП – 62,4, ЯП – 76,3 [5, 12]. Все реактивы и вода очищенная соответствовали фармакопейным требованиям [7].
Соки-фреш получены путем отжима измельченных ягод, плодов и овощей: клюквы, черной смородины, малины, черники, вишни, персиков, гранатов, лимонов, апельсинов, грейпфрутов, мандаринов, айвы, абрикосов, яблок, груш, слив, моркови, томатов.
Изучение влияния пектинов и ЩК (по 2·10-4 г/мл) на светопоглощение АК (2·10-5 г/мл) в водных растворах проведено путем выявления положения максимумов поглощения на электронных спектрах, зарегистрированных на спектрофотометре марки «СФ-26» в УФ области спектра в кюветах с толщиной слоя растворов 10 мм. При регистрации спектров отдельных компонентов (АК, ЩК, СП, ЦП, ЯП) раствором сравнения служила вода очищенная, при регистрации сочетаний АК - соответствующие пектины или ЩК (дифференциальные спектры).
Определение удельного показателя поглощения (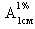 ) АК проводили для серии растворов, приготовленных путем растворения в воде очищенной навески АК массой около 0,5 г (точная навеска), доведения объема раствора водой очищенной до 100 мл, последующего разведения 10 мл полученного раствора водой очищенной до 200 мл (раствор А). Серию растворов готовили путем разведения водой очищенной аликвотных частей раствора А: 1 мл, 2 мл, 3 мл, 4 мл, 5 мл до объема 100 мл. Оптическую плотность растворов измеряли на спектрофотометре марки «СФ-26» при выявленной характеристической длине волны в кюветах с толщиной слоя растворов 10 мм; раствором сравнения служила вода очищенная. Величину
) АК проводили для серии растворов, приготовленных путем растворения в воде очищенной навески АК массой около 0,5 г (точная навеска), доведения объема раствора водой очищенной до 100 мл, последующего разведения 10 мл полученного раствора водой очищенной до 200 мл (раствор А). Серию растворов готовили путем разведения водой очищенной аликвотных частей раствора А: 1 мл, 2 мл, 3 мл, 4 мл, 5 мл до объема 100 мл. Оптическую плотность растворов измеряли на спектрофотометре марки «СФ-26» при выявленной характеристической длине волны в кюветах с толщиной слоя растворов 10 мм; раствором сравнения служила вода очищенная. Величину 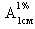 определяли по формуле (1) [7]:
определяли по формуле (1) [7]:
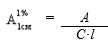 (1)
(1)
где А – оптическая плотность растворов,
С – концентрация АК в растворе, %,
l – толщина слоя раствора, см.
Установив величину 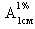 и учитывая разведения растворов, после преобразования формулы (1) вычисляли величину САК в растворах в присутствии вспомогательных веществ.
и учитывая разведения растворов, после преобразования формулы (1) вычисляли величину САК в растворах в присутствии вспомогательных веществ.
Выбор оптимального стабилизатора осуществляли по дифференциальным спектрам путем количественного определения АК в модельных смесях, содержащих в 1 мл 2·10-5 г АК и 2·10-4 г вспомогательного вещества, и хранящихся при температуре 20±2 ºС в течение 10 суток. Оптимальную дозу выбранного стабилизатора устанавливали также по количественному содержанию АК.
Подобранные на модельных растворах условия стабилизации АК были апробированы на соках, к которым было добавлено вспомогательное вещество в минимально установленной дозе с учетом концентрации АК в соке. Предварительно определяли концентрацию АК в соках путем титрования 5 мл сока в присутствии соляной кислоты 0,001 моль/л раствором 2,6-дихлорфенолиндофенолята натрия (титрование из микробюретки) до розовой окраски по методике определения АК в плодах шиповника [7]. Выбор данной методики связан с ее высокой специфичностью, позволяющей определять содержание АК в растительных объектах. Концентрацию АК в соке (С, мг%) вычисляли по формуле (2) [7]:
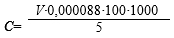 (1)
(1)
где: V – объем израсходованного титранта, мл; 0,000088 – титр раствора титранта, г/мл; 1000 – пересчет г в мг; 5 – объем сока, взятого на анализ, мл.
Из наиболее значимых физико-химических факторов, влияющих на устойчивость АК [2], мы отдали предпочтение рН и приведенной вязкости, изучение изменения которых может позволить выяснить причины стабилизирующего влияния вспомогательных веществ. Исследование провели путем сравнения физико-химических показателей и сроков хранения при температуре 20±2 ºС соков до и после их купажирования ЯП.
Выбор показателя «приведенная вязкость» обусловлен ее наибольшей селективностью к изменениям реологических свойств систем. Значения рН соков измерены на рН-метре марки «рН-340» с использованием хлоридсеребряного (электрод сравнения) и стеклянного (индикаторный) электродов при температуре 20±2 ºС. Приведенную вязкость (ηприв.) соков оценивали методом вискозиметрии с помощью капиллярного вискозиметра «ВПЖ-2» типа Убеллоде с диаметром капилляра 0,73 мм путем последовательного определения относительной (ηотн.), удельной (ηуд.) вязкости [7]. После термостатирования соков и растворителя (воды очищенной) при температуре 20±2 ºС в течение 20 мин, определяли их время истечения (соответственно τ и τ0); по полученным значениям вычисляли искомые величины, используя известные расчетные формулы (3, 4, 5) [7]:
ηотн. = τ/ τ0 (3)
ηуд. = ηотн. – 1 (4)
ηприв. = ηуд. /Сп (5)
где Сп – концентрация пектинов в соке, %.
Учет Сп обусловлен именно способностью пектинов к образованию вязких растворов [4]. Для купажированных пектинами соков величину ηприв. рассчитывали, исходя из суммарной Сп (исходного содержания в соках и содержания пектинов, добавленных к сокам).
Сроки хранения купажированных соков, помещенных во флаконы из полимерных материалов и сохраняемых при температуре 20±2 ºС, определяли по наличию характеристического максимума поглощения АК в дифференциальных УФ-спектрах.
При изучении каждого показателя проведено 5 параллельных испытаний. Статистическая обработка экспериментальных результатов включала определение: среднего значения, отклонения от среднего значения, числа степеней свободы, дисперсии, стандартного отклонения среднего результата, доверительного интервала (с заданной доверительной вероятностью 95% и коэффициентом Стьюдента 2,57), относительной погрешности определения [7].
Результаты и обсуждение
Электронные спектры поглощения АК, ЩК, пектинов в водных растворах, зарегистрированные на фоне воды в УФ области, приведены на рис. 1 (по оси ординат – оптическая плотность (А), по оси абсцисс – длина волны (λ, нм)). Согласно рис. 1, на спектральных кривых каждого вещества, кроме ЩК, выявлены характеристические максимумы: 264±2 нм для АК, 286±2 нм для СП, 282±2 нм у ЦП, 273±2 нм для ЯП.
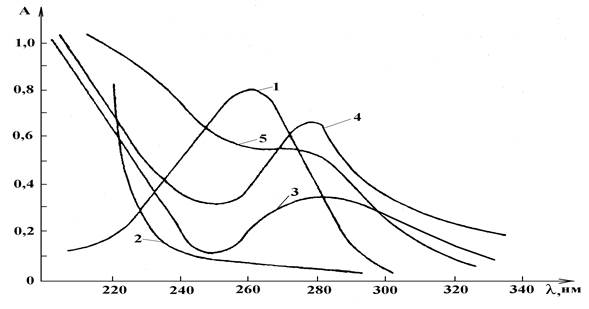
Рисунок 1. Электронные УФ спектры поглощения АК, ЩК, пектинов в водных растворах, зарегистрированные на фоне воды: 1 – АК, 2 – ЩК, 3 – СП, 4 – ЦП, 5 – ЯП
Электронные спектры смесей АК со вспомогательными веществами, зарегистрированные на фоне растворов вспомогательных веществ (дифференциальные спектры) в УФ области, приведены на рис. 2.
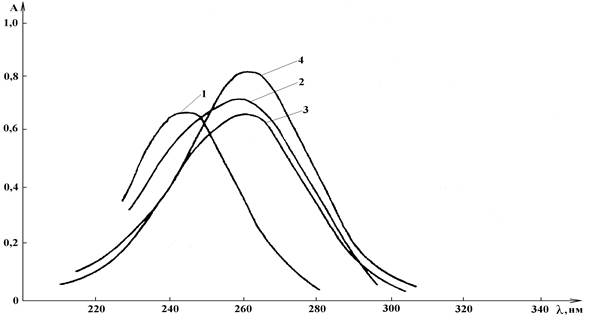
Рисунок 2. Дифференциальные электронные УФ спектры смесей АК со вспомогательными веществами: 1 – смесь АК и ЩК, 2 – смесь АК и СП, 3 – смесь АК и ЦП, 4 – смесь АК и ЯП
Анализ спектров свидетельствует о проявлении в смесях с различными веществами, кроме сочетания с ЩК (245±2 нм), характеристического для АК максимума поглощения: 263±2 нм для смеси с СП, 263±2 нм для смеси с ЦП, 264±2 нм для смеси с ЯП. Полученные данные свидетельствуют об отсутствии взаимодействия между АК и пектинами, т.е. о возможности определения АК в присутствии пектинов с помощью дифференциальных спектров. Сочетание АК с ЩК ведет к гипсохромному сдвигу максимума поглощения на 19 нм.
Результаты определения величины 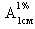 АК в водных растворах приведены в табл. 1.
АК в водных растворах приведены в табл. 1.
Таблица 1. Результаты определения величины 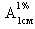 АК в водном растворе
АК в водном растворе
|
С АК, ·10-3% |
0,25±0,01 |
0,50±0,02 |
0,75±0,03 |
1,00±0,04 |
1,25±0,05 |
|
А |
0,182±0,009 |
0,365±0,015 |
0,550±0,020 |
0,725±0.026 |
0,90±0,032 |
|
|
728±32 |
730±29 |
733±29 |
725±30 |
720±28 |
Таким образом, среднее значение 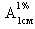 АК, необходимое для ее количественного определения, составило 727.
АК, необходимое для ее количественного определения, составило 727.
В результате экспериментального хранения водных растворов АК со вспомогательными веществами при температуре 20±2 ºС в течение наблюдаемого периода характеристический максимум поглощения АК (264±2 нм) сохранялся. При этом количественное содержание АК в зависимости от примененного вспомогательного вещества резко отличалось (рис. 3: по оси ординат – количественное содержание аскорбиновой кислоты (Х, %), по оси абсцисс – продолжительность хранения растворов (τ, сутки)).
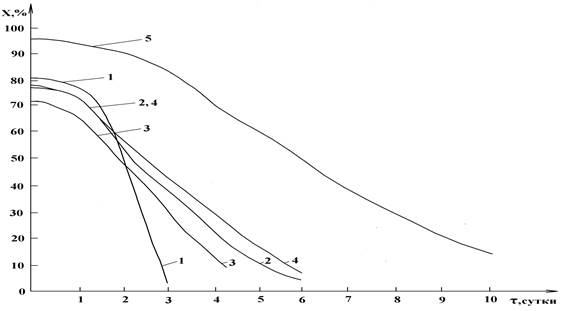
Рисунок 3. Количественное содержание АК в присутствии вспомогательных веществ при хранении: 1 – АК, 2 – смесь АК и ЩК, 3 – смесь АК и СП, 4 – смесь АК и ЦП, 5 - смесь АК и ЯП
При отсутствии вспомогательных веществ АК в водном растворе сохранялась только в течение первых суток (81-76%), в последующие двое суток концентрация резко снизилась (до 5,5%). ЩК и СП на устойчивость АК не оказали существенного влияния, хотя и продлили сохранность АК до 5 и 4 суток, обеспечив конечную концентрацию 11% и 16% соответственно. Действие ЦП на стабильность АК оказалось более заметным, как по продолжительности, так и по степени снижения концентрации АК. Неоспоримо лучшие данные получены при использовании ЯП: АК обнаруживалась в растворе в течение 10 суток (от 96% до 15%), снижение концентрации происходило плавно. По этим причинам ЯП нами выбран в качестве оптимального стабилизатора АК.
Результаты подбора оптимальной дозы ЯП для стабилизации АК в растворах приведены в табл. 2.
Таблица 2. Влияние соотношения АК:ЯП на устойчивость АК в растворе
|
С, г/мл |
Соотношение АК:ЯП, мас.ч. |
С, % при хранении |
||||
|
АК |
ЯП |
Свежеприготовленный |
1 час |
2 час |
3 час |
|
|
1,25·10-5 |
0,5·10-4 |
1:4 |
96,3±4,3 |
93,3±4,1 |
92,4±4,0 |
92,2±4,0 |
|
1,25·10-5 |
1,0·10-4 |
1:8 |
95,2±4,5 |
95,2±4,5 |
93,5±4,4 |
93,5±4,4 |
|
1,25·10-5 |
1,5·10-4 |
1:12 |
94,6±4,6 |
94,3±4,5 |
93,8±4,1 |
93,5±4,4 |
|
1,25·10-5 |
2,0·10-4 |
1:16 |
93,5±4,4 |
93,5±4,4 |
93,5±4,4 |
93,5±4,4 |
|
1,25·10-5 |
3,0·10-4 |
1:24 |
93,5±4,4 |
93,5±4,4 |
93,5±4,4 |
93,5±4,4 |
|
1,25·10-5 |
4,0·10-4 |
1:32 |
93,5±4,4 |
93,5±4,4 |
93,5±4,4 |
93,5±4,4 |
Полученные данные свидетельствуют об обеспечении стабильной концентрации АК в растворе при массовом соотношении АК:ЯП не менее 1:16.
Сравнительные физико-химические показатели соков до и после их купажирования ЯП приведены в соответствующих табл. 3 и 4.
Таблица 3. Физико-химические показатели и сроки хранения соков-фреш до купажирования
|
Наименование соков |
Сп, % [5] |
рН |
τ, сек |
ηотн. |
ηприв., м3/кг |
Срок, час |
|
Персиковый |
0,28 |
4,02±0,12 |
27,73±1,5 |
1,06 |
0,21±0,01 |
12 |
|
Морковный |
1,77 |
4,52±0,14 |
32,76±1,7 |
1,25 |
0,14±0,01 |
0,7 |
|
Клюквенный |
0,33 |
2,45±0,10 |
27,56±1,5 |
1,05 |
0,15±0,01 |
24 |
|
Черносмородиновый |
1,65 |
3,53±0,14 |
34,13±1,7 |
1,30 |
0,18±0,01 |
12 |
|
Гранатовый |
0,21 |
3,51±0,14 |
27,14±1,5 |
1,03 |
0,14±0,01 |
- |
|
Лимонный |
0,90 |
2,54±0,11 |
36,91±1,8 |
1,41 |
0,46±0,01 |
72 |
|
Апельсиновый |
0,75 |
3,54±0,14 |
29,61±1,5 |
1,13 |
0,17±0,01 |
48 |
|
Томатный |
0,19 |
4,32±0,17 |
26,70±1,5 |
1,02 |
0,11±0,01 |
12 |
|
Черничный |
0,31 |
2,96±0,10 |
27,67±1,5 |
1,05 |
0,16±0,01 |
48 |
|
Грейпфрутовый |
0,70 |
3,15±0,13 |
29,01±1,5 |
1,11 |
0,16±0,01 |
24 |
|
Мандариновый |
0,70 |
3,74±0,15 |
29,01±1,5 |
1,11 |
0,16±0,01 |
10 |
|
Малиновый |
0,45 |
4,11±0,16 |
27,56±1,5 |
1,05 |
0,11±0,01 |
10 |
|
Вишневый |
0,51 |
3,21±0,14 |
28,74±1,4 |
1,09 |
0,18±0,01 |
12 |
|
Айвовый |
0,80 |
2,97±0,10 |
29,82±1,5 |
1,14 |
0,18±0,01 |
5 |
|
Абрикосовый |
0,85 |
4,02±0,12 |
30,71±1,6 |
1,17 |
0,20±0,01 |
5 |
|
Яблочный |
0,45 |
3,53±0,14 |
28,38±1,5 |
1,08 |
0,18±0,01 |
4 |
|
Грушевый |
1,20 |
3,85±0,15 |
32,55±1,7 |
1,24 |
0,20±0,01 |
2 |
|
Сливовый |
1,15 |
3,06±0,12 |
31,08±1,7 |
1,18 |
0,16±0,01 |
24 |
Подписи к табл. 3: Сп – концентрация пектинов в соке, %; τ0 = 26,25 сек.
Таблица 4. Физико-химические показатели и сроки хранения соков-фреш после купажирования ЯП
|
Наименование соков |
V, мл |
САК, мг% |
Масса ЯП*, г |
рН |
τ, сек |
ηотн. |
ηприв., м3/кг |
Срок, сутки |
|
Персиковый |
11,36 |
19,99±1,00 |
0,320 |
5,22±0,23 |
34,44±1,7 |
1,31 |
0,52±0,03 |
2 |
|
Морковный |
6,00 |
10,56±0,52 |
0,169 |
5,37±0,21 |
35,91±1,8 |
1,37 |
0,19±0,01 |
1 |
|
Клюквенный |
5,68 |
10,00±0,48 |
0,160 |
3,83±0,17 |
29,85±1,5 |
1,14 |
0,29±0,02 |
6 |
|
Черносмородиновый |
4,55 |
8,01±0,40 |
0,128 |
4,21±0,18 |
37,00±1,8 |
1,41 |
0,23±0,01 |
5 |
|
Гранатовый |
2,84 |
5,00±0,25 |
0,080 |
4,53±0,19 |
27,85±1,4 |
1,06 |
0,21±0,01 |
0,5 |
|
Лимонный |
2,00 |
3,52±0,17 |
0,056 |
3,95±0,17 |
38,80±1,9 |
1,48 |
0,50±0,03 |
10 |
|
Апельсиновый |
2,00 |
3,52±0,17 |
0,056 |
4,92±0,21 |
31,76±1,6 |
1,21 |
0,26±0,01 |
9 |
|
Томатный |
1,70 |
2,99±0,14 |
0,048 |
5,22±0,23 |
27,12±1,4 |
1,03 |
0,13±0,01 |
5 |
|
Черничный |
1,14 |
2,01±0,10 |
0,032 |
4,52±0,19 |
27,96±1,5 |
1,07 |
0,20±0,01 |
7 |
|
Грейпфрутовый |
0,85 |
1,50±0,07 |
0,024 |
4,32±0,19 |
30,42±1,5 |
1,16 |
0,22±0,01 |
9 |
|
Мандариновый |
0,85 |
1,50±0,07 |
0,024 |
4,76±0,20 |
29,87±1,5 |
1,14 |
0,19±0,01 |
8 |
|
Малиновый |
0,85 |
1,50±0,07 |
0,024 |
4,84±0,21 |
27,75±1,5 |
1,06 |
0,13±0,01 |
4 |
|
Вишневый |
0,57 |
1,00±0,05 |
0,016 |
4,68±0,20 |
29,30±1,5 |
1,12 |
0,23±0,01 |
5 |
|
Айвовый |
0,56 |
0,99±0,05 |
0,016 |
4,64±0,20 |
30,53±1,5 |
1,16 |
0,20±0,01 |
2 |
|
Абрикосовый |
0,58 |
1,02±0,05 |
0,016 |
5,15±0,22 |
31,71±1,6 |
1,21 |
0,24±0,02 |
2 |
|
Яблочный |
0,45 |
0,79±0,04 |
0,013 |
4,83±0,19 |
29,03±1,5 |
1,11 |
0,24±0,02 |
10 |
|
Грушевый |
0,28 |
0,49±0,02 |
0,008 |
4,94±0,20 |
32,92±1,6 |
1,25 |
0,21±0,01 |
0,5 |
|
Сливовый |
0,23 |
0,40±0,02 |
0,004 |
4,43±0,19 |
31,40±1,5 |
1,20 |
0,17±0,01 |
6 |
Подписи к табл. 4: САК – концентрация АК в соке, мг%; τ0 = 26,25 сек; * - масса ЯП (г), добавленного к 100 мл сока.
Полученные данные свидетельствуют о достоверном стабилизирующем влиянии ЯП на АК в соках, доказательством чему служит следующее:
- сдвиг рН соков (кроме клюквенного, черносмородинового, лимонного и грейпфрутового соков) из среднекислой среды в оптимальную для АК область 4,5-8,0;
- повышение приведенной вязкости купажированных соков на 5-93%, а для персикового сока на 148%;
- увеличение сроков хранения соков при температуре 20±2 ºС: в 20-59 раз для яблочного, морковного и мандаринового соков, в 3,3-10 раз – для всех остальных соков.
По всей видимости, стабилизирующее влияние ЯП на АК в соках обусловлено, как физическими, так и химическими факторами. Физические факторы связаны со способностью высокомолекулярного и высокоэтерифицированного ЯП к образованию высоко вязких коллоидных растворов, затрудняющих диффузию кислорода воздуха, катализирующего разложение АК в соках [2, 4]. Это особенно актуально для сильно разбавленных растворов, к числу которых относятся соки. Химические факторы стабилизирующего эффекта ЯП обусловлены: сдвигом рН соков в область, оптимально приемлемую для образования устойчивой формы однозарядного аниона АК; способностью ЯП к связыванию ионов металлов - катализаторов процесса разложения АК [4]. В отличие от ЯП, ЩК в смесях с АК создает среднекислую реакцию среды (рН 3,3), образует практически нерастворимые соединения с ионами металлами («оксалатные камни»), оказывает непродолжительное влияние на устойчивость АК, не способна стабилизировать АК в растворах с концентрацией менее 10-3 г/мл [2]. Кроме того, в отличие от ЩК, ЯП, будучи компонентов фруктов, овощей, растений, биологически совместим с организмом человека [4].
В результате статистической обработки полученных данных (в таблицах приведены доверительные интервалы) установлены следующие пределы относительной погрешности определений: ±0,7-0,8% (выявление максимумов поглощения); ±4,0-4,4% (определение 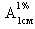 ); ±4,3-4,9% (изучение соотношений АК:ЯП); ±3,0-4,4% (определение рН); ±4,8-5,6% (определение τ); ±2,2-9,1% (определение ηприв.), ±4,1-5,1% (определение САК).
); ±4,3-4,9% (изучение соотношений АК:ЯП); ±3,0-4,4% (определение рН); ±4,8-5,6% (определение τ); ±2,2-9,1% (определение ηприв.), ±4,1-5,1% (определение САК).
Выводы:
Доказана возможность применения ЯП, очищенного от минеральных элементов и флавоноидов, в качестве стабилизатора АК в соках-фреш с концентрацией АК 1·10-6-1·10-4 г/мл:
1. АК и пектины в УФ спектрах имеют близкие характеристические максимумы поглощения: АК - 264 нм, СП - 286 нм, ЦП - 282 нм, ЯП - 273 нм. В смесях АК с пектинами при использовании дифференциальной спектроскопии пектины не мешают определению АК (263±2 нм).
2. По оптической плотности серии водных растворов с концентрацией АК (0,25-1,25) ·10-3% определен удельный показатель поглощения АК, составивший 727.
3. Используя удельный показатель поглощения АК, вычислено количественное содержание АК в модельных водных смесях с пектинами при их хранении. При отсутствии пектинов, АК в растворе сохраняется только в первые сутки. Вспомогательные вещества пролонгируют устойчивость АК: ЩК – до 5 суток, СП – до 4 суток, ЦП – до 6 суток, ЯП – до 10 суток. ЯП выбран в качестве оптимального стабилизатора АК.
4. Стабильная концентрация АК в модельных растворах достигается при минимальном массовом соотношении АК:ЯП 1:16.
5. В соках-фреш, полученных путем отжима измельченных ягод, плодов и овощей (18 видов), методом титрования раствором 2,6-дихлорфенолиндофенолята натрия определена концентрация АК, составившая 0,40-19,99 мг%. Соки-фреш, с учетом содержания АК, были купажированы ЯП, исходя из массового соотношения АК:ЯП 1:16, и оставлены на хранение при температуре 20±2 ºС до 10 суток.
6. Сравнительная оценка исходных и купажированных соков по физико-химическим показателям позволила установить, что добавление ЯП к сокам способствует: смещению рН из среднекислой среды в область рН 4,5-8,0, оптимальную для АК; увеличению приведенной вязкости соков на 5-148%. Кроме того, добавление ЯП способствует увеличению сроков хранения яблочного, морковного и мандаринового соков при комнатной температуре в 20-59 раз, остальных соков - в 3,3-10 раз.
7. Статистически обработанные результаты исследования всех показателей, кроме ηприв., характеризуются значениями относительной погрешности определений в пределах ±0,7-5,6%. Относительная погрешность определения ηприв находится в пределах ±2,2-9,1%.
