В современном мировом акушерском сообществе началось осознание того, что именно существующие серьёзные пробелы в общей теории родового процесса у человека становятся одной из важнейших причин, негативно влияющих на прогресс практического родовспоможения. Одной из таких проблем теоретического акушерства продолжает оставаться понимание сути механизма, осуществляющего координацию (синхронизацию, интеграцию) индивидуальной сократительной активности миллиардов миоцитов мышечной оболочки матки во время родового сокращения [28,29,30,31]. Известно, что с середины прошлого века в зарубежном теоретическом акушерстве занял доминирующие позиции фундаментальный догмат, содержание которого в современной интерпретации звучит так: «миометрий сокращается тогда и только тогда, когда находится под воздействием электрогенного потенциала действия» [31]. Этот догмат стал научным фундаментом, так называемой пейсмекерной концепции механизма координации сократительной деятельности миометрия в родах, которая с середины 70-х годов прошлого века безраздельно доминирует в отечественном теоретическом акушерстве [1,2,3,4,5,6,8,11,12,13 и мн.др.]. Более того, многие выдающиеся представители отечественной акушерской элиты уже на протяжении полувека продолжают попытки активного внедрения положений пейсмекерной концепции регуляции сократительной деятельности матки человека в практику родовспоможения [1,2,3,4,5,12,13,23,24,25]. В хрестоматийном варианте классическая пейсмекерная концепция в отечественной литературе преподносится следующим образом: «К началу родов в фундальном отделе матки формируется водитель ритма (пейсмекер), способный генерировать электрогенные потенциалы действия, которые распространяются по всему миометрию в виде нисходящей волны возбуждения, которая последовательно вовлекает в сократительный процесс всё новые и новые регионы миоцитов, образуя, таким образом, нисходящую волну сокращения мышечной оболочки матки. При этом, достигая каждого отдельного миоцита потенциал действия не только инициирует фазное сокращение клетки, но, одновременно, модулирует его, определяя продолжительность и силу сокращения, а также координирует фазную сократительную активность клеток, формируя нисходящую волну сокращения, которая и совершает полезную внешнюю работу (доминанта дна матки, тройной нисходящий градиент, ретракция, реципрокность)» [1,2,3,4,5,12,13,23,24,25]. Этот «монопейсмекерный» вариант концепции с «нисходящей волной возбуждения» до сих пор остаётся научной доминантой отечественного акушерства [1,2,3,4,5,8,11,23,24,25]. Поразительно, но среди «старых» и «новых» критиков положений «классической» монопейсмекерной концепции нет понимания того, что утверждение примата потенциала действия как основного регулятора сократительной деятельности миометрия в родах автоматически возводит в ранг другого догмата утверждение о том, что координированная с помощью потенциала действия эффективная сократительная деятельность миометрия является единственным производителем родовых сил. И в этой, фундаментальной по значению проблеме, выявляются два стержневых аспекта. Следовательно, во-первых, необходимо понять как с помощью генерируемого пейсмекером потенциала действия происходит процесс координации сократительной деятельности различных структурных элементов миометрия, а, во-вторых, с помощью каких механизмов эта координированная сократительная деятельность конвертирует энергию своего интегрированного сокращения в родовые силы. Иными словами в проблеме биомеханики родового сокращения матки человека в родах существуют два самостоятельных аспекта, каждый из которых требует отдельного изучения. Прежде всего, это необходимо для определения роли каждого из них в физиологии и патологии сократительной деятельности матки. В данной статье, используя опыт изучения специальной литературы и, главное, данные собственных тридцатилетних исследований мы попытаемся обсудить только первый аспект этой проблемы. Судя по достаточно декларативным высказываниям наших зарубежных коллег, появившихся в самое последнее время [28,29,30,31], этот аспект проблемы сегодня является «большим пробелом» в понимании механизма координации сократительной деятельности различных структурных элементов миометрия в родах. Они, также как и мы [14,15,17,20,21], полагают, что классический вариант пейсмекерной концепции координации сократительной деятельности миоцитов рожающей матки человека, основным создателем которого считают R. Caldeyro-Barcia [27], в настоящее время не имеет серьёзной доказательной базы [28,29,30,31].
Например, W. Lammers [28] в 2013 году уверенно констатирует, что: «…уже очень много известно о том, как сокращаются миоциты, однако существует большой пробел в понимании того, как миллиарды миоцитов координируют индивидуальные сокращения в сокращения на органном уровне в родах». Он откровенно сетует на то, что «…природа и роль маточных пейсмекеров в течение долгого времени являются источником противоречий» [28]. А R. Robotti и M. Mischi [29] в 2015 году касаясь проблемы маточных пейсмекеров уже говорят о том, что «…основные фундаментальные физиологические вопросы остаются без ответа, в том числе количество водителей ритма, содержащихся в матке – являются они или нет постоянными, их локализация в маточной оболочке, из какого типа клеток они состоят и какие клеточные механизмы служат пусковыми для возникновения потенциала действия». Современные отечественные специалисты, например авторы Национального руководства по акушерству [4,5] продолжают поддерживать веру в реальное существование «синусового узла» R. Caldeyro-Barcia [27], другие авторы (Б.Г. Ермошенко и соавт. [10]) честно признают, что документированное доказательство наличия пейсмекера в матке человека отсутствует, третьи ищут функциональные суррогаты водителей ритма, приписывая их роль неким кластерам миоцитов [11]. Факт остаётся фактом: на сегодняшний день прямых доказательств реального существования в рожающей матке человека такого образования, как водитель ритма не существует! Более того, сегодня признано, что в рожающей матке человека отсутствует такой феномен как «нисходящая волна возбуждения», в составе которой пейсмекерный потенциал действия распространяется по всему миометрию от фундального до истмического отделов органа [28,29,30,31]. Возникает вопрос – насколько научно легитимна версия пейсмекерной концепции механизма координации индивидуальной сократительной деятельности миоцитов миометрия в родах, если два основных «фигуранта» версии - пейсмекер и нисходящая волна возбуждения не имеют прямых документальных доказательств своего реального существования? В официальном отечественном акушерстве ответа на этот вопрос нет. Более того – и в наши дни отечественная акушерская элита не только продолжает следовать идеологии пейсмекерной концепции регуляции родовой деятельности у человека, но и с не меньшим упорством продолжает «внедрять» её основные догматы в мировоззрение практических врачей [1,2,3,4,5,8,11,23,24,25]. Ярким тому примером может служить до сих пор «процветающее» учение о «дискоординированной родовой деятельности», основу патогенеза которой составляет представление о патологии несуществующего пейсмекера и генерируемой им волны возбуждения [1,2,3,4,5,8,11,23,24,25].
Поразительно, но за почти полувековую историю безальтернативного доминирования пейсмекерной концепции в отечественном акушерстве на официальном уровне ни разу не обсуждались иные представления о предмете – они, якобы, «не востребованы». Разве только И.С. Сидорова [23,24,25] внесла «поправку» в классический вариант концепции, согласно которому в регуляции фазного родового сокращения миометрия помимо пейсмекера одновременно участвует «попеременное возбуждение симпатической и парасимпатической вегетативной нервной системы». Определённой новацией, пожалуй, можно считать и то, что в последнем томе Национального руководства по акушерству [5], вопреки изложенному во всех предыдущих его изданиях, появилось неожиданное утверждение: «…патогенез гипертонической дисфункции матки (дискоординации родовой деятельности) неизвестен. Между тем ещё в 80-е годы прошлого века мы предложили для обсуждения и продолжаем до сих пор развивать свою концепцию механизма синхронизации (координации) индивидуальной сократительной деятельности миоцитов миометрия во время родовой схватки человека [15,17,19,20,21]. В этой концепции отсутствует пейсмекер, нисходящая волна возбуждения и, самое главное, отрицается наличие специального потенциала действия, без внешнего воздействия которого на клетку возможна индукция фазного сокращения миоцита. Несмотря на то, что за все три десятилетия существования наша концепция не была рассмотрена на официальном уровне, ни одно из её фундаментальных положений не только не было опровергнуто, но даже не было подвергнуто публичному сомнению.
Цель настоящей публикации состоит в том, что мы в очередной раз изложим свои представления о биологической сущности механизмов, с помощью которых индивидуальные сокращения миллиардов миоцитов миометрия синхронизируются в родовые сокращения матки. Формат статьи предопределил её дизайн. Она будет представлена в виде краткого обзора наших публикаций, имеющих прямое отношение к анализируемому вопросу.
Мы подтвердили, что в морфологической структуре рожающей матки человека к родам формируются особого рода изменения, которые определяют особенности функции органа, в том числе благодаря которым функционирует механизм синхронизации сократительной деятельности миоцитов миометрия. В миометрии рожающей матки человека многоуровневая функциональная организация его структурных элементов, в конечном счёте позволяющих каждому отдельному миоциту во время схватки становится частью функционального целого [15,16,17,18,19,20,21]. Миоцит миометрия (утеромиоцит) – это высоко специализированная гладкая мышечная клетка, прошедшая во время беременности процессы «растяжения» и «гипертрофии покоя», обладает мощным миофибриллярным аппаратом, способным развивать только линейные натяжения по оси клетки. Линейные натяжения миофибриллярного аппарата клетки могут проявляться в виде постоянного напряжения (тонического), либо в виде фазного сокращения (дискретная форма натяжения). К началу родов активированы и тонические и фазные компоненты активности клетки. Итак, силовую основу миометрия рожающей матки человека представляет утеромиоцит, который является элементарной сократительной единицей миометрия.
На первом уровне морфофункциональной организации происходит объединение утеромиоцитов в первичные или малые цилиндрические пучки (рис. 1А). Основу таких пучков составляют сократительные субъединицы – цепочки последовательно (конец-в-конец) соединённых между собой утеромиоцитов. Обычно семь таких цепочек упакованы в собственный соединительнотканный матрикс, состоящий из наружной оболочки (гексагональная упаковка) (Рис. 1А - 1) и индивидуальных ячеек, фиксирующих каждый миоцит в пучке. Большая часть утеромиоцитов одной цепочки, вопреки распространённым представлениям [4,5,8,10,11,23], не имеют прямых контактов с утеромиоцитами расположенных рядом параллельных цепочек. То есть уже на этом первом уровне морфофункциональной организации утеромиоцитов рожающей матки человека никаких морфологических признаков организации «электропроводного функционального синцития» мы не нашли. Но уже на этом уровне организации стало очевидным, что уже на подуровне структурной организации утеромиоцитов в малом цилиндрическом пучке должны функционировать два механизма синхронизации индивидуальной сократительной деятельности утеромиоцитов – продольно действующий по оси каждой цепочки, синхронизирующий сократительную деятельность каждого миоцита этой цепочки, и смешанный, синхронизирующий сократительную деятельность всех цепочек утеромиоцитов, локализованных в малом цилиндрическом пучке. Малый цилиндрический пучок можно рассматривать как первичную организованную сократительную единицу миометрия. Как и элементарные сократительные единицы миометрия малые цилиндрические пучки способны генерировать только линейные, направленные по оси пучка, натяжения.
Следующий уровень морфофункциональной организации миометрия рожающей матки человека представлен большим цилиндрическим пучком – основной сократительной единицей мышечной оболочки матки – её функциональным сократительным модулем (Рис. 1Б). Несколько десятков малых цилиндрических пучков (60-80), плотно прижатых друг к другу, расположены по длине модуля вращаясь по спирали вдоль его продольной оси с очень большим шагом. Модуль имеет плотную соединительнотканную оболочку. Внутри модуля все, составляющие его сократительную систему, малые цилиндрические пучки прочно связаны между собой соединительнотканными перемычками. Благодаря спиралеобразному «ходу» малого цилиндрического пучка его длина больше, чем длина самого модуля. Все малые цилиндрические пучки, входящие в состав каждого модуля, имеют единые анатомические точки фиксации в месте локализации точки анатомической фиксации самого модуля. Так же, как в малом цилиндрическом пучке, силовая миоархитектоника модуля предопределяет возможность генерации только линейных натяжений, направленных по оси модуля. Также очевидно, что параметры генерируемого модулем линейного натяжения зависят от линейной и смежной координации индивидуальных сокращений всех структурных элементов, из которых «построен» сам модуль. Из рис. 1В можно понять, что морфологической основой наружного и внутреннего слоёв миометрия тела матки, мышечной основой контракционного кольца и стенки нижнего сегмента является функциональный сократительный модуль. Из их множества каждый принимает участие в создании, во-первых – петлисто-ячеистой структуры с трёхмерным ходом волокон в наружном и внутреннем мышечных слоях тела матки, двухмерной петлисто-ячеистой структуры стенки нижнего сегмента и, во-вторых – создаёт сложную петлевую систему с функцией «удавки» на границе корпорально-истмического соустья, что разделяет мышечную оболочку матки на два функциональных отдела (Рис. 1В).
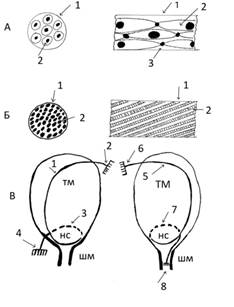
Рис. 1 Схема морфофункциональной организации утеромиоцитов мышечной оболочки рожающей матки человека.
А - поперечный (слева) и продольный (справа) срез малого цилиндрического пучка
1 - оболочка пучка
2 – утеромиоциты
Б – поперечный (слева) и продольный (справа) срез функционального сократительного модуля.
1 – соединительнотканная оболочка модуля
2 – малые цилиндрические пучки со спиралевидным ходом по оси модуля
В - слева - локализация в маточной оболочке функционального сократительного модуля первого типа, справа – второго типа.
1 – функциональный сократительный модуль миометрия первого типа
2 – “верхняя” точка анатомической фиксации модуля (круглая маточная связка).
3 – “петля” модуля в области контракционного кольца
4 – “нижняя” анатомическая точка фиксации модуля (одна из фиксирующих матку связок)
5 – функциональный сократительный модуль миометрия второго типа
6 – “верхняя” точка анатомической фиксации модуля
7 – “петля”
8 – “нижняя” анатомическая точка фиксации модуля (зона истмико-цервикального соустья)
Таким образом, есть все основания утверждать, что большой цилиндрический пучок действительно является основным функциональным сократительным модулем, от синхронизированного (координированного) совместного фазного сокращения в родах которого зависит то количество энергии, которое может с помощью других механизмов конвертироваться в полезную внешнюю работу. Но при этом очевидно, что особенности соединительнотканного матрикса и миоархитектоники функциональных сократительных модулей создают систему, эргономические и биомеханические особенности которой предопределяют одновременное функционирование механизмов, обеспечивающих продольную и смежную координацию индивидуальных сокращений всего сообщества модулей конкретного функционального отдела матки. Вероятно, этому тоже может способствовать то, что связанные в матриксе маточной оболочки абсолютно все её сократительные элементы к началу родов находятся в одинаковой степени принудительного растяжения.
Установлено, что в мышечной оболочке рожающей матки человека отсутствуют признаки прямой нервной регуляции сократительной деятельности миоцитов, полностью отсутствуют какие-либо признаки наличия её пейсмекерной регуляции и нет доказательных данных о наличии признаков химической регуляции каждого, подчёркиваем, каждого отдельного фазного сократительного цикла. Следовательно, есть все основания считать, что механизмы, инициирующие родовое сокращение каждого утеромиоцита, модулирующие параметры и фазного и тонического сокращения, равно как синхронизирующие (координирующие) эти сокращения являются миогенными, заложенными в геноме клетки и реализуются только в родах, материализуясь физически в виде фундаментальных механических свойств мышцы. Мы, опираясь на мировой опыт подобного рода исследований, показали, что выявление фундаментальных механических свойств миометрия рожающей матки человека возможно в опытах на изолированных полосках мышцы [15,16,17,18,19,20,21,22]. Несмотря на то, что идеология и методология этих исследований многократно и в подробностях освещались нами ранее [15,16,17,18,19,20,21,22], мы ещё раз хотели бы обратить внимание на соблюдение нами жёстких стандартов наших опытов. Так, мы исследовали только фрагменты миометрия из маток женщин, которые удалялись в родах, происходивших при доношенной беременности. Фрагменты миометрия забирались из препарата матки сразу же после её удаления. «Рабочая полоска», используемая в опыте, независимо от того из какого отдела матки она иссекалась, имела размеры 10х1,0 мм и имела массу ≈ 10 мгр. Все полоски после помещения в перфузионную камеру дискретно растягивались до 2l0 (20 мм) и после находились в условиях суперфузии до начала опыта около 1,5 часов, то есть в условиях длительного «отмыва» в среде, в которой отсутствовали тономоторные факторы.
Что нам удалось уточнить? Поскольку при микроскопическом исследовании используемые нами образцы миометрия по своим метрическим и структурным характеристикам соответствовали фрагменту функционального сократительного модуля, то мы считали, что получаемые нами результаты экспериментальных исследований характеризуют именно фундаментальные механические свойства этой сократительной единицы миометрия. Действительно, находящаяся в перфузионной камере без внешней нагрузки в состоянии полного изотонического сокращения полоска миометрия не проявляет каких-либо признаков спонтанной активности и, что важно, в ней не удаётся вызвать фазную активность при этой длине.
Все без исключения полоски миометрия при приложении к ним внешней силы (импульсы дорастяжения) реагируют на изменение внешней нагрузки одинаковой тономоторной реакцией, состоящей из «острой» фазы сопротивления растяжению (Рис. 2А), последующей довольно длительной фазы приспособления к новой длине и новому значению внешней нагрузки (Рис.2Б). Реакция заканчивается фазой плато (Рис. 2В), характеризующейся новым уровнем тонического напряжения полоски при её новой длине.
При каждом последующем импульсе дорастяжения возрастает абсолютная величина каждой из трёх доминант, характеризующих тономоторную реакцию полоски в целом (Рис. 2 А,Б,В). Подобный тип тономоторных реакций на изменение внешней нагрузки характерен для вязко-эластических тканевых структур, обладающих к тому же способностью изменять величину активного сопротивления тканей растягивающей силе в дискретном режиме. Несомненно, что в фазе острого противодействия растягивающей силе (Рис. 2А) ей противостоит активное сокращение утеромиоцитов полоски. Для нас важно то, что по мере роста величины сопротивления растягивающей полоску силе растёт и величина её тонического сопротивления, достигаемого после окончания фазы адаптации полоски к новой длине. Не исключая важной роли соединительнотканного компонента миометрия в организации подобного типа тономоторной реакции на импульс дорастяжения ткани, всё же следует считать основным компонентом реакции активное участие гладкомышечного звена полоски. Таким образом, активируемые импульсом дорастяжения утеромиоциты проявляют свойства рецепторов растяжения, которые обладают свойствами не только воспринимать изменения внешней нагрузки, но и активно адекватно реагировать на неё. Тот факт, что независимо от места иссечения полоски из препарата удалённой матки все полоски одинаково реагируют на импульс дорастяжения, может свидетельствовать в пользу наличия в рожающей матке человека феномена функциональной гомогенности утеромиоцитов, локализованных в различных отделах миометрия. Объём использованных нами в опытах полосок миометрия близок к 10 мм3. По нашим данным объём гипертрофированного утеромиоцита к началу родов в матке in situ достигает 4500-5000 мкм3. Это означает, что в полосках мышцы, которые мы использовали, содержалось около 1,2х106 утеромиоцитов. То есть с формальной точки зрения полоска является многоуровневой системой, объединяющей миллионы утеромиоцитов, имеющих между собой механическую связь, обеспечиваемую прямыми контактами клеток «конец-в-конец» и смежной связью через матрикс в малых цилиндрических пучках и самих этих пучков между собой во фрагменте модуля. На рис. 3-1 видно, что после достижения полоски при растяжении длины в 1,5 L0 (пятый импульс дорастяжения) в изолированной мышце, находящейся без воздействия каких-либо средств и веществ, влияющих на моторику миоцитов, возникает спонтанная сократительная активность фазного типа, которая регистрируется при изометрическом режиме работы мышцы (при сохранении постоянной длины полоски). Дальнейшее импульсное растяжение мышцы сопровождается повышением тонического напряжения, возрастанием амплитуды фазного сокращения, которые достигают максимума при длине полоски в 2L0 (Рис. 3-2). Дальнейшее импульсное дорастяжение полоски сопровождается снижением амплитуды фазного сокращения, снижением величины максимума активного напряжения полоски на пике сокращения при дальнейшем повышении тонического напряжения. На диаграмме (Рис. 3 внизу) видна зависимость величины максимального напряжения достигаемого полоской на пике сокращения от её длины. При длине равной 2L0 (20 мм) достигается максимальная величина активного напряжения на пике сокращения, которая в среднем во всех образцах составляла ≈ 9,8 г (Н/см2). То есть полоски, иссечённые из разных отделов миометрия, при их стандартных метрических характеристиках (длина 10 мм, толщина 1,0 мм, объём 10 мм3) при 2L0 развивают одинаковую величину линейного напряжения (≈ 10 г) на пике спонтанного сокращения. Этот факт также свидетельствует в пользу наличия функциональной гомогенности утеромиоцитов миометрия, особенно если учесть, что 2L0 полоски в эксперименте соответствуют длине растянутого к началу родов любого участка мышечной оболочки тела матки. Важно ещё раз подчеркнуть, что прямое механическое воздействие на утеромиоциты полоски (импульс дорастяжения) стало единственной причиной активации фазной спонтанной сократительной активности полоски после того, как она «достигла некоего рубежа растяжения» в 1,5L0. Используя эту же схему опытов мы показали, что максимальная величина напряжения достигаемая на пике индуцированного (окситоцин, электрический импульс) фазного сокращения полоски также близка к 10 Н/см2 только при 2L0.
При ориентации на результаты этой серии опытов появилась возможность полагать, что в условиях наличия функциональной гомогенности утеромиоцитов, наличия между мышечными клетками морфологических связей, способных транслировать от клетки к клетке механическое воздействие, само это воздействие, например – импульс дорастяжения, становится основным фактором активации любого вида сократительной активности клеток и, в том числе, фактором синхронизации этой активности.
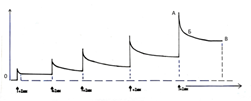
Рис 2. Типичная (стандартная) тономоторная реакция полоски изолированного миометрия человека на импульс дорастяжения при искусственном увеличении ее длины.
Обозначения: слева по вертикали прилагаемая для дорастяжения полоски сила (Н/см2),
по горизонтали – время тономоторной реакции полоски.
а – фаза острого сопротивления тканей полоски растягиваемой силе
а-б – период ускоренного, б-в – замедленного снижения тонического напряжения дорастянутой полоски, то есть фаза адаптации к ее новой длине с функцией нового, более высокого базального тонуса.
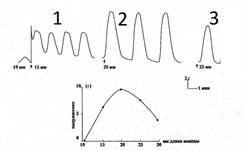
Рис. 3 Зависимость величины изометрического максимума спонтанного сокращения изолированного миометрия человека от степени его дорастяжения.
Обозначения: 1,2,3 – величины изометрического максимума при различной степени растяжения полоски миометрия (15,20,25 мм).
Проверить это утверждение мы смогли, применив иную схему экспериментов [15,16,17,18,19]. Главная цель этой серии опытов состояла в изучении условий, при которых две изолированные полоски миометрия, находящиеся в одной перфузионной камер, смогут синхронизировать свою индивидуальную сократительную активность. На рис. 4А отражена схема опыта, в котором каждая полоска миометрия имеет свою индивидуальную точку фиксации, и полоски не имеют между собой морфологически или механически значимых связей. После синхронного растяжения полосок до 2L0 в каждой из них развилась спонтанная сократительная активность характеризующаяся индивидуальным фазным ритмом при её одинаковых силовых параметрах. Никакими способами внешнего воздействия на полоски (окситоцин, электроимпульс) синхронизировать сокращения полосок не удаётся.
В следующих опытах (рис. 4Б) использовалась единая в морфологическом отношении полоска миометрия которая имела две вертикальные части, каждая из которых имела свои верхнюю и нижнюю точки фиксации и горизонтальную часть – тканевую перемычку, которая соединяла между собой две вертикальные части единой полоски. Растяжению подвергались только две вертикальные части, в которых после достижения 2L0 активировались спонтанные сокращения фазного типа. При этом ритм сокращений каждой вертикальной части был свой. Также, как в первом опыте (рис 4А), в этом варианте исследования никакими внешними воздействиями на полоску синхронизировать сокращения вертикальных частей не удалось. В следующем варианте опытов (рис. 4В) две изолированные полоски миометрия своими нижними концами крепились к концам пластмассового коромысла, которое, в свою очередь, крепилось к дну камеры за свой центр. С помощью коромысла была создана прямая механическая связь между полосками миометрия, которая позволяла свободно транслировать любой импульс силы с одного конца коромысла на другой – последний мгновенно воспринимался механорецепторным аппаратом каждой мышечной полоски. После синхронного растяжения полосок до 2L0 все сокращения обеих полосок стали абсолютно синхронизированы. Любые воздействия как на обе полоски (окситоцин), или на одну из них (электроимпульс) вызывало синхронизированный ответ всей системы. В систему превратились две изолированные полоски мышцы после того, как обрели прямую механическую связь между собой. Прямой мы называем эту механическую связь потому, что независимо от физической природы её субстанции она способна прямо транслировать механический импульс от одной клетки или группы клеток к другой, обеспечивая их физическое и биомеханическое единство.
С точки зрения биомеханики в миометрии рожающей матки женщины могут одновременно функционировать три вида прямой механической связи, обеспечивающих мгновенную передачу любого импульса дорастяжения с клетки на клетку от места первичного воздействия импульса на всю мышечную оболочку матки и все её функциональные отделы [15,16,17,18,19,21]. Первый вид связи обеспечен наличием плотных контактов между концами утеромиоцитов в любой «цепочке», входящей в состав каждого малого цилиндрического пучка. Особенности топологии и миоархитектоники миометрия на любом уровне его морфофункциональной организации обеспечивают возможность смежной боковой передачи импульса дорастяжения, деформируя боковой отдел клетки с помощью соединительнотканных структур, механически объединяющих отдельные клетки, «цепочки» клеток, малые и большие цилиндрические пучки.
Боковые деформации клеток мгновенно отражаются на величине мышечного напряжения их миофибриллярных структур, активируя механорецепторные механизмы обратной связи по растяжению. Оба этих вида прямой механической связи по природе своей являются внутритканевыми, скорее даже внутримышечными, в которых используются гладкомышечные и соединительные ткани матрикса миометрия.
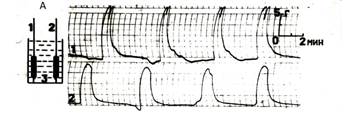
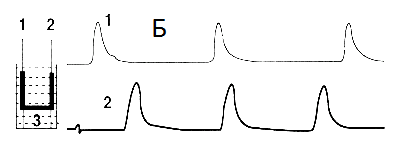
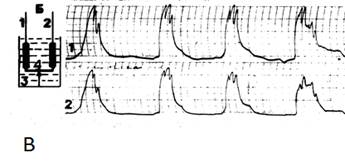
Рис. 4 Опыты с двумя работающими полосками миометрия, помещёнными в одну перфузионную камеру.
А – обе полоски не имеют между собой ни морфологической, ни прямой механической связи.
Б – полоски имеют между собой морфологическую связь, которая не выполняет функции прямой механической связи.
В – полоски имеют между собой прямую механическую связь, обеспеченную инородной субстанцией. (Пояснения в тексте)
Третий вид механизма прямой передачи импульса дорастяжения в тканевых структурах миометрия рожающей матки человека является «побочным» продуктом механизма конвертации энергии изометрического сокращения утеромиоцитов в родовые силы. При этом субстратом передачи импульса силы служит кровь (жидкая, несжимаемая в данных условиях, среда), содержащаяся в венозных синусах миометрия (венозное депо) и амниотическая жидкость. Физическую, биомеханическую и физиологическую сущность этого вида механической передачи силового импульса в работающем в родах миометрии человека в данной статье мы обсуждать не будем, поскольку этот вопрос нами подробно обсуждён ранее [17,18,19]. Принципиальной важнейшей особенностью этого вида механизма передачи импульса дорастяжения является сочетание гидродинамического импульса, возникающего в ответ на повышение внутритканевого давления при сокращении утеромиоцитов с увеличением гидравлического объёма крови. Если учесть, что:
- утеромиоцит миометрия рожающей матки человека обладает собственным, генетически детерминированным внутриклеточным механизмом управления тонической и фазной активностью;
- утеромиоцит при этом обладает свойствами высокочувствительного механического рецептора, способного реагировать на малейшие изменения внешней нагрузки на концах клеток;
- для активации всех этих функций абсолютно необходим фактор растяжения клеток - то становится очевидным, что в родах миометрий функционирует как самонастраивающаяся, саморегулируемая система, в основе работы которой лежит механохимическая трансдукция.
Проверить это предположение мы пытались в следующей серии модельных экспериментов [16,17,18,19,20,21]. Принципиально важной особенностью этой серии являлось нахождение двух разных полосок миометрия в индивидуальных изолированных друг от друга перфузионных камерах. То есть полоски мышцы находились в условиях полной химической и электрической изоляции. Их соединяло между собой только коромысло особой конструкции (коромысло Савицкого II), которое обеспечивало наличие прямой механической связи между ними (Рис. 5).
Из рисунка 6 (А) видно, что, как спонтанные, так и вызванные электрическим импульсом (справа) одиночные сокращения одной полоски дублируются другой в «зеркальном отражении». На рисунке 6 (Б) видно, что введение в перфузат окситоцина вызывает развитие типичной реакции в обрабатываемой препаратом полоске. Подобная «типичная» реакция повторяется в другой полоске в том же «зеркальном отображении» хотя в её перфузионной камере отсутствует окситоцин. Из рис. 6 (Б) видно, что «ведомая» полоска, не испытывающая на себе действие окситоцина, идеально повторяла «в механическом выражении» типичный окситоциновый комплекс, возникнувший в «ведущей» полоске, находясь при этом с ней только в прямой механической связи. Эта связь обеспечивалась вышеописанным коромыслом, конструкция которого позволяла свободно транслировать механические импульсы, возникающие в «ведущей» полоске. Наложение стопора на центр коромысла, который препятствовал движениям последнего на станине, прекращало трансляцию механических импульсов с полоски на полоску и единая биомеханическая система переставала существовать. Окситоцин, вводимый в перфузат одной камеры, вызывал типичную реакцию только у обрабатываемой полоски. Окситоцин в таких опытах вызывает, прежде всего, активацию тонического компонента сократительной активности полосок и довольно выраженную активацию её фазного компонента. Есть все основания полагать, что препарат воздействует на миофибриллярный аппарат клетки не непосредственно через активацию имеющихся в ней специальных «центров», ответственных за тоническую и фазную активность. Препарат воздействует на клетку перманентно (его концентрация в перфузате определённое время поддерживалась постоянной), а механическая реакция миофибриллярного аппарата по своему характеру дискретна, то есть она опосредована деятельностью этих центров, которые обеспечивают эту дискретность. Но каким образом вызывается «зеркальная» реакция в «ведомой» полоске, которая связана с «ведущей» только посредством прямой механической связи? Окситоцин в наших экспериментах выступает в роли внешнего внеклеточного средства химической регуляции сократительной деятельности утеромиоцита. А проведённые нами опыты доказывают, что механическое воздействие на клетку тоже является и инициатором, и модулятором, и координатором её сократительной активности. Следовательно, сохраняется возможность того, что механический импульс может влиять на миоцит либо через активацию внутриклеточных центров управления её тоническим и фазным компонентами сокращения, либо непосредственно воздействуя на миофибриллярный аппарат утеромиоцита. Проверить это предположение мы пытались в следующем эксперименте (Рис. 6В). В камеру с полоской №1 на всём протяжении опыта в перфузат добавлялся верапамил, который, блокируя кальциевые каналы, фактически блокировал фазный и тонический компоненты сократительной деятельности растянутой до 2L0 полоски мышцы. Это было проверено тем, что в перфузат одновременно добавлялся окситоцин и даже хлористый калий, вызывающий калиевую контрактуру. Все подробности опыта описаны нами ранее [16,17,18,19,20,21]. Никакой реакции на введение этих препаратов со стороны обработанной верапамилом полоски не последовало. В камеру полоски №2 в перфузат был добавлен окситоцин – последовало развитие типичной реакции на препарат. Поразительно, но ставшая «ведомой» полоска №1, сократительная деятельность которой была «заблокирована» верапамилом, «зеркально» повторила реакцию на окситоцин, возникшую в полоске №2. Тот же эффект был и при калиевой контрактуре полоски №2. Следовательно есть все основания полагать, что при наличии прямой механической связи между миоцитами любое изменение внешней нагрузки на концах клеток воспринимается, прежде всего, её миофибриллярным аппаратом. Именно способность миофибриллярного аппарата адекватно реагировать на малейшие изменения внешней нагрузки и определяет наличие у утеромиоцита свойств механорецептора. В основе адекватной реакции на импульс дорастяжения лежит феномен механохимической трансдукции, когда механический импульс запускает развитие химических реакций в миофибриллах, результатом которых является генерация механической энергии. Вероятность подобного развития событий в своё время блестяще обосновал В.И. Дещеревский [9]. Тот факт, что в условиях внешней блокады сократительной активности утеромиоцитов верапамилом эта полоска сохранила способность адекватной реакции на импульс дорастяжения, даёт основания полагать, что в основе синхронизации сократительной деятельности утеромиоцитов рожающей матки человека лежит механорецепторный механизм обратной связи по растяжению. Его физико-химической основой является способность миофибриллярного аппарата клетки использовать феномен механохимической трансдукции. Любой внешний импульс дорастяжения прямо воздействует на миофибриллярный аппарат клетки, что вызывает развитие в нём синергических энергообразующих химических реакций, позволяющих генерировать механическую контрсилу, адекватно противодействующую внешнему импульсу силы.
Следовательно, синхронизированное (координированное) фазное сокращение миллиардов утеромиоцитов во время родовой схватки у женщины является продуцентом взаимозависимого и взаиморегулируемого взаимодействия следующих факторов:
- активации тонического и фазного компонента сократительной активности всех утеромиоцитов, входящих в состав мышечной оболочки матки;
- активации механорецепторных свойств всех утеромиоцитов, исходно находящихся в одинаковой степени напряжения и имеющих на конце любой клетки одинаковую степень внешнего натяжения;
- наличие между всеми утеромиоцитами всех морфоструктур миометрия рожающей матки человека всех видов прямой механической связи, обеспечивающей мгновенную трансляцию любого импульса дорастяжения по всей мышечной оболочке матки.
Пусковыми механизмами фазной сократительной деятельности миометрия в родах являются:
- повышение тонического напряжения утеромиоцитов, резко увеличивающее чувствительность механорецепторных систем каждой гладкомышечной клетки;
- активация пейсмекерного механизма каждого утеромиоцита, которая обеспечивает развитие фазной сократительной активности каждой клетки, каждая из которых становится генератором внешнего импульса растяжения для своей «соседки», имеющей с ней прямую механическую связь.
Итак, ни мифический пейсмекер с его потенциалом действия, ни нисходящая волна возбуждения миометрия, а банальный механический импульс дорастяжения, генерируемый каждым активированным к родам утеромиоцитом, является фактором синхронизации сократительной деятельности многомиллиардного сообщества утеромиоцитов рожающей матки женщины.
Ни изменения мембранного потенциала, ни появление потенциала действия, сопровождающих сократительный цикл каждой клетки, не являются инициаторами или индукторами развития физико-химических процессов, протекающих в клетке во время её фазного сокращения. Они лишь отражают изменения физико-химической среды в сокращающейся клетке.
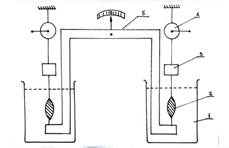
Рисунок 5.
Коромысло Савицкого-2. Обозначения: 1- резервуар; 2 – растянутая до 2L0 полоска миометрия; 3 – тензодатчик; 4 – система растяжения; 5 - жёсткое коромысло.
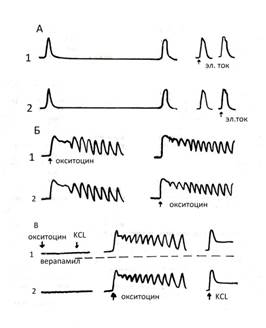
Рис 6. Различные варианты опытов изучения сократительной активности изолированных полосок, находящихся в разных перфузионных камерах, связанных “коромыслом Савицкого-2”.
Обозначения:
А – синхронные сокращения двух изолированных полосок миометрия, находящихся в перфузионных камерах
Слева – редкие спонтанные сокращения
Справа – попеременное воздействие электрического тока на полоски, находящиеся в разных камерах
Б – попеременное воздействие на каждую полоску окситоцина. Типичная реакция “ведущей” полоски идеально воспроизводится “ведомой” полоской, находящейся в другой перфузионной камере и не испытывающей контакта с окситоцином
В – опыт с полоской, сократительная активность которой блокирована антагонистом кальция (верапамил). Достигнут полный мышечный блок – полоска не реагирует на введение в перфузат ни окситоцина, ни хлористого кальция (верхняя кривая слева). Введение окситоцина и хлористого кальция в другую перфузионную камеру вызвало развитие характерной реакции не только у полоски, подвергнутой прямому воздействию этих препаратов, но и “ведомой”, находящейся в другой перфузионной камере под “верапамиловым блоком”.
