Введение: Роль инфекции в этиологии и патогенезе хронического гнойного и гнойно-полипозного риносинусита значима. Поэтому эти нозологии постоянно находятся в центре внимания у ринологов. Этому способствует, с одной стороны совершенствование уровня бактериологической диагностики, а с другой, с устойчивостью микрофлор. [1,2]. Появление устойчивых форм микроорганизмов способствуют появлению воспалительного процесса в полости носа и в околоносовых синусах и непременно способствуют его развитию.
В данном сообщении, мы на основании собственных исследований и данных периодической литературы, сочли целесообразным дать сравнительный анализ микрофлоры в полости носа и верхнечелюстной пазухи при хроническом гнойном и гнойно-полипозном воспалении.
Результаты бактериологических исследований экссудата при хроническом воспалении отличаются от гнойно-полипозного воспаления. По данным D.N.F. Fairbanks (2016) [3], при хроническом синусите в содержимом из пазух обнаруживаются: Staphylococcus aureus выделяется у 4% больных, нередко грамотрицательные стафилококки, Streptococcus hemolyticus - 6%, Streptococcus pyogenes (B hemolyticus) - 3%, Streptococcus pneumoniae - 2%, Haemophillus spp. – 4%, Moraxella cаtarrhalis - у 4%, Peptostreptococcus spp. - 22%, Prevetella spp. - у 15%, Bacteroides spp. - у 8%, Propionibacterium spp. – у 7%, Fusobacterium spp. - у 5% больных. При хроническом процессе более разнообразной является грибковая флора. Наряду с представителями рода Candida обнаруживаются и представители родов Aspergillus и Penicillinus [4].
При хронических гнойно-полипозных риносинуситах пейзаж микроорганизмов тоже разнообразен. Ведущее значение среди бактериальных инфекций придают Staphylococcus aureus [5,6,7].
При хроническом гнойном, так и гнойно-полипозном процессе в пазухах одинаково часто высеивались грибки рода Candida (24,3%- 24,6%). Это дает основание считать, что грибковой инфекции, следует уделять серьезное внимание в поражениях параназальных синусов, поскольку в отдельных случаях оно сопровождается серьезными изменениями в костных структурах параназальных синусов и даже развитием внутриглазничных осложнений и тромбозов кавернозного синуса [8]. По последним данным Европейской академии аллергологии и клинической иммунологии (European Academy Allergology and Clinical Immunologe — EAACI Position Paper on Rhinosinusitis and Nasal Polyps — EPOS, 2012-2020), распространенность полипозных риносинуситов варьируются от 1 до 4% и в последнее время установлено, что грибковая флора, вегетирующая в полости носа и в пазухах может быть причиной развития аллергического риносинусита [9]. Также, согласно по некоторым данным при грибковых поражениях на рентгенологическом и томографическом исследовании параназальных синусов иногда вызывает необычную картину. Например, структура от известковой до металлической плотности. Описавший ее H.Stammberger (1985) эти изменения считает, что постепенный рост мицелия ведет к образованию структур и грибковых масс. Их генез он объясняет отложением фосфата и сульфата кальция, которые ассимилируются из секрета слизистой оболочки. В центре таких отложений определяются признаки некроза и лизиса [10]. Согласно по литературным данным, длительное и упорно рецидивирующее течение риносинуситов в 12,4% наблюдений связано с микотическим поражением параназальных синусов. При этом наиболее часто в воспалительный процесс такого генеза вовлекается верхнечелюстная пазуха. В других исследованиях обращают внимание на то, что в таких пазухах преобладают грибы рода Candida, Aspergillus и Penicillinum [11].
Цель исследования – провести сравнительный анализ микробиологических исследований у больных с хроническим гнойным риносинуситом и с полипозным образованием в полости носа на основании литературы и собственных исследований.
Материалы и методы исследования. К бактериологическому исследованию с идентификацией и подсчетом колоний использовались материалы, полученные от 107 стационарно и амбулаторно наблюдавшихся пациентов с хроническим воспалением верхнечелюстной пазухи и с полипозным образованием, в отделении оториноларингологии-хирургии головы и шеи Национального госпиталя Министерство Здравоохранения Кыргызской Республики. В данной группе 77 пациентов были с хроническим гнойным воспалением верхнечелюстной пазухи, в возрасте от 18 до 60 лет, из которых мужчин - 45 (58,4%), женщин - 32 (41,2%). У 38 пациентов полученный экссудат издавал неприятный запах, у 39 пациентов имел крошковидный вид. Во всех случаях он содержал примесь слизи. Подавляющее большинство этих больных беспокоило слабость и боль в области пораженной пазухи, а также головная боль. Вместе с этим, 30 пациентов с хроническим гнойно-полипозном риносинуситом в возрасте от 20 до 65 лет, из которых: мужчин – 17 (56,6%), женщин – 13 (43,4%). У всех пациентов с хроническим гнойно-полипозным воспалением параназальных синусов в просвете полости носа имелся гнойный экссудат и полипозное образование.
Особое внимание уделялось забору материала для бактериологического исследования. Микрофлоры, полученные из полости носа и околоносовых пазух, идентифицировали и выделяли в виде отдельных культур для дальнейшего исследования по методическим основам, изложенным в приказе Министерства Здравоохранения Кыргызской Республики №4 от 11.01.2010 г. «Об утверждении методических указаний по бактериологическим методам лабораторных исследований клинического материала (с изменениями от 18.11.2016 г.)». Для выделения микроорганизмов полученный материал засевали в сахарный и питательный бульоны. Их инкубировали в термостате при Т +37ºС в течение 24-48 часов. На первичные субкультуры производили на 5% кровяной и мясопептонный агары для выращивания и определения количества колонизации бактерий. С той же целью использовали среду Эндо для выращивания Enterobacteriaceae и Pseudomonas aeruginosa – агар цитрамида. После выявления микрофлор колоний, производили их идентификацию и определяли чувствительность к лекарственным препаратам. После выделения чистой культуры бактерий и грибков, наносили исследуемый штамм на соответствующие среды: обнаружение других элементов грибковой микрофлоры выделяли в нативном материале методом микроскопии «раздавленной капли». Для определения актиномицетов ее окрашивали по Романовскому-Гимзе и затем микроскопировали. Вторым этапом микологического исследования являлась культуральная диагностика, для чего полученный материал засевали на плотную питательную среду Сабуро и культивировали посевы в термостате при температуре 30ºС, а затем укладывали изготовленные диски в определенном порядке. Через 24-36 часов определяли наличие роста микробиомы или его отсутствие вокруг каждого диска. Зону подавления роста микрофлор вокруг каждого диска измеряли в милиметрах и сравнивали со стандартными значениями, индивидуальными для каждого микроорганизма и для антибактериального и противогрибкового препарата. Полученные результаты микробиологических исследований оценивались по категориям: Н, Ч, В (нечувствительные, чувствительные, высокочувствительные).
Результаты исследований и их обсуждение. Выполняя представленную работу прежде всего, мы сочли необходимым изучить колонизацию различных представителей микрофлор, полученных из экссудата полости носа и верхнечелюстной пазухи при названной патологии у жителей Кыргызской Республики, особенность которой следует учесть. Полученные результаты микробиологических исследований позволили нам дать характеристику возбудителей, имеющих этиопатогенетическую роль в возникновении и течении хронического гнойного и гнойно-полипозного воспаления верхнечелюстных пазух. В зависимости от экологических условий окружающей среды и достижений современной фармации, такие данные со временем меняются. Вышеперечисленные факторы отражаются на видовой состав микрофлоры и на ее чувствительности к лекарственным препаратам [12,13].
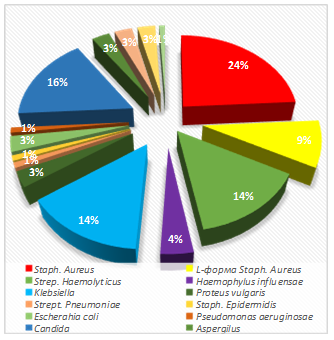
В содержимом из пазух при хроническом гнойном воспалении обнаруживались: Staphylococcus aureus - 17% и его устойчивая L-форма Staphylococcus - 11% в пределах с колонизацией менее от 102 до 107 КОЕ/мл, Streptосoccus hemolyticus - 14% от 102 до 104 КОЕ/мл, Streptococcus pneumoniae - 2% от 102 до 104 КОЕ/мл, Haemophillus influensae - 5% от 102 до 104 КОЕ/мл , Klebciella oxytoca - 12%, Escherichia coli - 4% от 102 до 104 КОЕ/мл, Proteus vulgaris - 2% от 106 до 108 КОЕ/мл и другие микрофлоры - 3%. Роста не обнаружена - 11%.
Грибковой этиологии - 19%, из них рода Candida - у 13%, представители родов Aspergillius у 4% и Penicillinus - у 2% (диаграмма 1).
Проведенные исследования дали возможность выделить и идентифицировать 33 штаммов у 30 пациентов с хроническим гнойно - полипозным риносинуситом, которые имели бактериальную природу. Бактериальная микрофлора у каждой из обследованных групп больных имела отличие в представительстве микроорганизмов.
 |
|
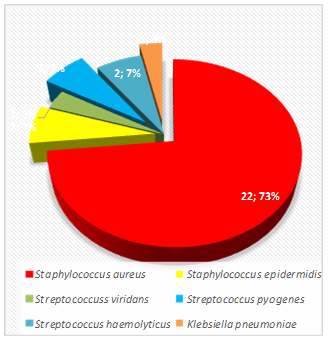
Диаграмма 1. Частота регистрации видовой характеристики микрофлоры, 77 – больных с хроническим гнойным риносинуситом, в графическом изображении
|
Диаграмма 2. Частота регистрации видовой характеристики микрофлоры, 30-больных с хроническим гнойно- полипозным риносинуситом, в графическом изображении |
При хроническом гнойно-полипозном риносинусите преобладал Staphylococcus aureus в пределах с частотой менее 102 до 107 КОЕ/мл - у 22 пациентов, Staphylococcus epidermidis от 103 до 106 КОЕ/мл - у 2, Streptococcus viridans до 102 КОЕ/мл - у 1, Streptococcus pyogenes от 102 до 104 КОЕ/мл - у 2, Streptococcus haemolyticus от 102 до 104 КОЕ/мл - у 2, Klebsiella pneumoniae до 103 КОЕ/мл - у 1 (диаграмма 2).
Учитывая отмеченное, что отсутствие данных об анаэробной инфекции в наших исследованиях объяснимо отсутствием технических возможностей, позволяющих выделять этих представителей микромира, число, так называемых стерильных гнойных экссудатов из параназальных синусов, практически исчезло после внедрения в практику современных бактериологических методик, позволяющих обнаружить и идентифицировать неклостридиальных анаэробов.
Выводы:
1. Микрофлора, высеянная из полости носа и верхнечелюстных пазух при гнойном воспалении околоносовых пазух и гнойно-полипозном риносинусите представлена аэробами, анаэробами и грибками, что соответствует данным литературных источников.
2. Проведенные исследования подтвердили высокую частоту патогенных бактерий в полости носа при полипозном риносинусите золотистым стафилококком, а также грамотрицательных бактерий, что подтверждает их участие в воспалительных реакциях, лежащих в основе возникновения и прогрессирования полипоза носа.
3. Состав, распределение и численность микрофлоры влияют на состояние слизистой оболочки полости носа, а также на рост и функцию патогенов.
Библиографическая ссылка
Эргешова А.М., Карагулова М.М., Исакова А.К., Токтоболот Кызы Ч.Т. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА МИКРОФЛОРЫ ПРИ ХРОНИЧЕСКИХ ГНОЙНЫХ И ГНОЙНО-ПОЛИПОЗНЫХ РИНОСИНУСИТАХ // Научное обозрение. Фундаментальные и прикладные исследования. 2023. № 3. ;URL: https://scientificreview.ru/ru/article/view?id=110 (дата обращения: 15.01.2026).
DOI: https://doi.org/10.17513/srfar.110
