Введение. Хорошо известно, что одним из фундаментально значимых биомеханических феноменов, которые во многом определяют эффективность и безопасность течения первого периода родов, является функционирование механизма инициации фазных родовых сокращений миометрия - механизма, который вовлекает в фазное родовое сокращение мышечную оболочку матки. Сегодня - в третьем десятилетии XXI века, хорошо известно, что такой механизм в рожающей матке человека функционирует. Более того, когда применяется индукция родов, родовозбуждение, родостимуляция или, наоборот, токолиз, воздействие осуществляется именно на этот механизм. Однако, например, в отличие от кардиологов, до мельчайших деталей познавших функционирование механизмов инициации сердечного сокращения,акушеры до сих пор не располагают внятными, хорошо документированными, и наконец, научно обоснованными представлениями о биомеханической сущности механизма инициации фазного сокращения миометрия беременной или рожающей матки человека [1,2,3].В зарубежной литературе с 50-х годов прошлого века применительно к проблемам инициации родового сокращения матки используются два терминологических понятия - «generation» и «propagation». Первое – «генерация», свидетельствует об обязательном наличии некоего образования, способного генерировать особого рода сигнал, воздействие которого на миометрий вызывает в нём обязательную ответную реакцию-сокращение. Второй – «распространение», предопределяет возможность свободного распространения этого сигнала по миометрию с той или иной формой вовлечения его сократительных элементов в фазный сократительный процесс [4,5]. Единодушно, без каких-либо колебаний или сомнений, в те же 50-е годы прошлого века акушеры приняли на веру догмат о том, что миометрий сокращается «тогда и только тогда, когда на него воздействует потенциал действия электрогенной природы». Значит сигнал, индуцирующий фазное родовое сокращение миометрия — это потенциал действия. Значит, солидарно решили акушеры того времени, в механизме инициации фазного сокращения миометрия должны фигурировать минимум два обязательных компонента, а именно: а) пейсмекер - генератор потенциала действия и б) система проведения этого сигнала до сократительных элементов миометрия. R. Caldeyro-Barcia - блестящий физиолог и не менее искусный экспериментатор, имевший возможность проводить свои эксперименты на беременных и рожающих женщинах – добровольцах, совместно с опытным акушером H. Alvarez, его бывшим преподавателем акушерства - в 50-е годы прошлого столетия предложили мировому сообществу первую в мире модель, в которой на органном уровне функционировала система инициации и координации фазных сокращений мышечной оболочки рожающей матки человека [6].
Сущность первой модели инициации родового сокращения матки человека, которая связана с именем Роберто Кальдейро-Барсия, заключалась в следующем. К моменту начала родов в одном, чаще правом (зависимость не установлена) трубном углу матки появлялся некий синусовый узел, способный генерировать потенциал действия, который в виде нисходящего возбуждения распространялся от дна матки к её шейке последовательно возбуждая фазные сокращения различных отделов миометрия - дна, тела, нижнего сегмента. Биомеханическая формула этой модели инициации родового сокращения матки оказалась простой, дидактически совершенной и сразу же обрела статус базовой концепции: пейсмекер → волна возбуждения →сокращение.
Концепция имела оглушительный успех и вплоть до конца 60-х годов прошлого века рассматривалась как некий фундаментальный бренд, характеризующий уровень интеллекта акушера. Дальнейшее существование этой базовой модели Кальдейро-Барсия в научном акушерстве, которая, подчёркиваем, существовала как базовая концепция, не поддаётся анализу ни с гносеологических, ни с когнитивных точек зрения. Дело в том, что к концу 60-х годов прошлого века акушерское сообщество осознало то, что в рожающей матке человека этот самый «синусовый» узел - «одиночный фиксированный пейсмекер», обнаружить не удаётся, а к началу 80-х годов стало очевидным, что тот самый «явный» потенциал действия пейсмекерного происхождения не может распространяться по миометрию с заявленной скоростью и далеко не на такие длительные расстояния, которые заявлялись, как достоверно установленные.
Но парадокс заключается в том, что даже осознание этих фактов не привело к смене парадигмы базовой модели, в которой доминировала необходимость наличия объекта, генерирующего потенциал действия, и убеждённости в наличии формы (форм) распространения этого потенциала по миометрию, как единственного фактора вовлечения утеромиоцитов в сократительный процесс. Эта концепция продолжала оставаться незыблемой, ортодоксально - аксиоматической с такой степенью доверия, что любые отличные от неё гипотезы считались «научной чушью» и даже конструктивно не обсуждались. Но, тем не менее, уже с середины 60-х годов прошлого века в научном акушерстве началась эпоха «пейсмекероискательства» и поиска способов проведения потенциалов действия по миометрию, которая продолжается до сих пор. Основным мотивом для продолжения этих не прекращающихся до сих пор исканий служит ослепляющая и, к сожалению, временами даже агрессивная вера в непогрешимость основного догмата концепции – «…миометрий сокращается тогда и только тогда, когда на него воздействует потенциал действия». Следует отметить, что, также до сих пор сохраняется «гипнотическое» воздействие базовой модели на представителей современной акушерской отечественной элиты с полным отсутствием их внимания на иные концепции в этой области, которые с феноменально фанатичным, почти солиптическим, упорством продолжают относить к категории завиральных идей.Уместно в этой связи заметить, что авторы этой статьи не раз выражали своё негативное отношение и к модели R. Caldeyro-Barcia [7,8,9] и к этому основополагающему догмату [10,11,12], оценивая их как псевдонаучные квазиконцепции после получения доказательных данных, которые позволяют отнести эту теорию к уже исторической фактологии [13,14]. Тем не менее попытки реабилитировать не столько саму модель R. Caldeyro-Barcia, сколько основополагающий догмат «пейсмекер-потенциал действия-возбуждение-сокращение» начались уже в семидесятые годы прошлого века и без какого-либо успеха, но с завидным упорством продолжаются до сих пор.
Материалы и методы. Первая попытка была предпринята A. Csapo - руководителем известной научно-исследовательской лаборатории в 1970 году [15]. Вторая, также не очень успешная, попытка была предпринята G.M. Wolfs и M. van Leeuwen в 1979 году [16]. И A. Csapo, также G.M. Wolfs и M. van Leeuwen исходили из предположения того, что в рожающей матке человека функционирует несколько или, даже, некое множество пейсмекеров, обеспечивающих электрическое и механическое сопряжение такого же множества мелких сегментов миометрия. Однако, в родах по случайному выбору должен доминировать один из пейсмекеров, который и отвечает за ритм сокращений. Ни в той, ни в другой модели их авторы не осветили вопросов синхронизации сокращения этого множества регионов, которые, например, G.M. Wolfs назвал «сократительными единицами», а A. Csapo допускал участие в этом процессе повышенного внутриматочного давления без конкретизации своей идеи.
Несколько неожиданно на запрос реабилитации модели R. Caldeyro-Barcia, ставшей уже «классикой», отреагировала отечественная акушерская элита, предложив свою модель. Это была пейсмекерно - нейрогенная схема сокращений миометрия, точную дату появления которой и членов авторского коллектива, представившего эту модель, установить не удалось. Но к началу 80-х годов прошлого века она была сформулирована и в своём первозданном виде фигурирует на страницах всех отечественных учебников и клинических руководств по акушерству в качестве безальтернативной доминирующей в отечественном теоретическом акушерстве модели инициации родового сокращения матки человека.В этой модели в качестве синергично функционирующих систем, которые одновременно инициируют, синхронизируют и модулируют фазное родовое сокращение, существует как пейсмекер с его потенциалом действия и нисходящей волной возбуждения, так и система прямой нервной регуляции сократительной деятельности миометрия. Цитируем:
· «… от физиологического равновесия симпатической и парасимпатической нервной систем и локализации водителя ритма в миометрии зависит координированность сокращений продольных мышечных пучков при активном расслаблении циркулярно и спиралеобразно расположенных мышечных волокон. В свою очередь функция вегетативной нервной системы в определённой степени подчинена регуляции со стороны коры головного мозга и структур лимбического комплекса, осуществляющего наиболее тонкую регуляцию родов».
· «…в родах возникают однонаправленные перистальтические сокращения дна, тела и нижнего сегмента матки, обеспечивающие изгнание плода и последа. Наиболее сильные и продолжительные сокращения матки происходят в дне матки. Каждое возбуждение клетки - источник импульсов возбуждения соседних клеток. Попеременное возбуждение симпатической и парасимпатической нервной системы вызывает сокращение продольно расположенных мышечных пучков матки одновременно с активным расслаблением циркулярных и спиралеобразных мышечных пучков, что приводит к постепенному раскрытию маточного зева и продвижению плода по родовому каналу».
· «…нейрогенная регуляция обеспечивается вегетативной нервной системой, функция которой подчинена коре головного мозга и лимбическим структурам. Все отделы матки имеют двойную вегетативную иннервацию:
ü симпатическая нервная система иннервирует наружные и мощные слои миометрия в теле матки;
ü парасимпатическая нервная система иннервирует внутренние (субваскулярные) слои, наиболее выраженные в нижнем сегменте и шейке матки».
Вызывает удивление факт необычайной живучести этой гибридной пейсмейкерно - нейрогенной модели, которая безальтернативно доминирует на страницах отечественных изданий уже четыре десятка лет будучи, как концепция, дважды псевдонаучной. Дело в том, что авторы статьи ещё в семидесятые годы прошлого века выявили интересный факт сопряжения процесса гипертрофии утеромиоцитов миометрия с процессом денервации мышечной оболочки матки [7,8,9], который выражается в виде нарастающего процесса дегенерации нервных проводников и окончаний с их последующим лизисом по мере возрастания функциональной массы миометрия [11,12,13].
После длительного перерыва в зарубежной литературе появились публикации R.C. Young [17,18,19], в которых представлен новый вариант модели, так называемая «двойная модель» по мнению автора которой, она позволяет приблизиться к пониманию механизма инициации родового сокращения матки не выходя за пределы положений догмата «пейсмекер - потенциал действия – возбуждение – сокращение». Автор концепции - доктор медицины R.C. Young [20,21,22], позиционирует познавательный и доказательный потенциал концепции довольно высоко, полагая, что в ней, как минимум, удалось преодолеть существенные недостатки всех представленных выше в обзоре моделей. Учитывая, что во всех публикациях R.C. Young, касающихся проблем его двойной модели, есть авторская трактовка его биомеханической конструкции, представляем возможность самому автору модели обозначить её биомеханическую суть, цитируем: «…Авторами была предложена двойная модель передачи сигналов матки на уровне органов - в попытке разрешить дилемму потенциала действия. В двойной модели распространения потенциала действия остаётся основным сигнальным механизмом на расстоянии менее ≈ 10 см. Это расстояние представляет собой среднее расстояние, на которое потенциал действия распространяется в стенке матки, и определяет «область». «Области» электрически независимы. На больших расстояниях для участия в сокращениях привлекаются новые области за счёт локального увеличения натяжения стенок, вызванного повышением внутриматочного давления (например, механотрансдукцией). Как отмечалось выше, все участки стенки матки испытывают примерно одинаковое давление, но локальное натяжение стенки изменяется в зависимости от локального радиуса кривизны и толщины стенки. Это создаёт иерархию восприимчивости к стимуляции путём механотрансдукции в разных местах матки. Поскольку повышающееся давление подаёт сигнал к сокращению, последовательно набираемые участки не обязательно соприкасаются или даже находятся близко к области, которая уже сокращается. Благодаря этому механизму биоэлектрическая активность распространяется по всей матке, как представляется случайным образом». Как и модель A. Csapo, двойная модель предполагает, что каждое сокращение начинается со спонтанного проявления потенциала действия, не обязательно в определённом месте. Потенциал действия последовательно распространяется примерно на 10 см и вызывает первое региональное сокращение. Первое сокращение лишь незначительно повышает внутриматочное давление, поскольку большая часть стенки матки расслаблена и растягивается по мере повышения давления. Небольшое повышение давления увеличивает натяжение стенок по всей матке, изменяемое за счёт локальной толщины стенки и локального радиуса кривизны.
Следующие шаги в двойном механизме отличаются от предыдущих моделей. Если имеется миометрий, который достаточно восприимчив к небольшому повышению напряжения, то механотрансдукция инициирует другой потенциал действия в этом месте и происходит другое региональное сокращение. Это ещё больше повышает давление и натяжение стенок что запускает больше потенциалов действия и задействует больше областей. По мере того, как в сокращении участвуют всё больше областей, давление продолжает расти, напряжение стенок увеличивается, и активизируются даже менее восприимчивые области. Преобразование расслабленной области в сокращающуюся снижает податливость матки, что также способствует повышению внутриматочного давления. В совокупности эти шаги демонстрируют положительную обратную связь и сотрудничество.
Сильные схватки возникают, когда в сокращении одновременно участвуют большинство участков стенки матки. Однако, если начального повышения давления недостаточно для инициирования дополнительных потенциалов действия посредством механотрансдукции, процесс останавливается, предотвращая развитие сильных сокращений, даже несмотря на то, что биоэлектрическая активность была выражена в некоторых участках стенки матки.
Двойная модель требует дальнейших уточнений, два из которых перечислены ниже. Во-первых, механически индуцированные сокращения были описаны в миометрии, но механизм не был установлен. Возможности включают активируемые растяжением ионные каналы, активируемые напряжением высвобождения IP3 (инозитолтрифосфат) или выработку простагландинов при увеличении напряжения. Во-вторых, двойная модель использует механизм механотрансдукции для инициирования региональных сокращений по мере прогрессирования схватки, но механизмы, которые инициируют первое региональное сокращение не рассматриваются».
Согласно мнению самого автора двойной модели в ней есть только два изъяна. Первый - отсутствуют представления о первом «пейсмекере», генерирующем первый потенциал действия, который понуждает к сокращению первый «изолированный регион миометрия». И второй - он признаёт, что полного понимания механизма механотрандукции пока не существует. И, самое главное, R. Young [22] констатирует, что его двойную модель надо рассматривать не как противопоставление традиционным взглядам, а как дальнейшее развитие концепции потенциала действия.
Этим признанием и честной констатацией факта наличия принципиально важных несоответствий в своей двойной модели, которые идеологически и методологически совместимы с подобного рода несоответствиями модели R. Caldeyro-Barcia, автор двойной модели R. Young [21,22] приводит уровень её доказательности к уровню доказательности базовой модели R. Caldeyro-Barcia [6]. И единственным формальным отличием этих моделей является использование в двойной модели представлений о механизме механотрансдукции. Цитируем: «…поскольку в матке отсутствуют эфферентные нервы, влияние центральной нервной системы или автономный контроль маловероятны. Аутокринная или паракринная передача сигналов слишком медленная и непредсказуемая, чтобы надёжно регулировать функции на уровне органов. Однако известно, что гладкие мышцы сокращаются в ответ на механическую симуляцию – процесс, называемый механотрансдукцией. Клинические наблюдения показывают, что в матке беременной человека функционирует механическая сигнализация, то есть резкое надавливание на матку на поздних сроках беременности может инициировать схватки. Более ранние публикации о беременной матке грызунов продемонстрировали, что сокращение двух маточных рогов могут синхронизироваться с использованием давления в качестве единого сигнального механизма. Подтверждающие последующие исследования продемонстрировали, что механическая стимуляция полоски миометрия беременной крысы сокращениями второй полоски миометрия инициировала потенциалы действия и приводила к синхронизированным сокращением. Эти результаты также связали механическую стимуляцию синхронизацией сокращений через электрическую возбудимость миометрия и показали, как механотрансдукция может быть механизмом передачи сигналов на уровне органов, в то же время полагаясь на потенциалы действия на уровне миоцитов и миометрия».
В 1965 году H. Takeda, который сотрудничал с лабораторией A. Csapo и в том же году опубликовал с ним одну из двух своих работ, поместил в моноавторстве в журнале «Fertility and sterility» статью под интригующим названием «Generation and propagation uterine activity in situ» [23]. Необычна «судьба» этой публикации. В своих обзорах, обсуждавших проблемы генерации и распространения потенциалов действия в миометрии рожающей матки, A. Csapo (1970) об этой статье не упомянул ни разу [15].Её не цитировали вплоть до 1984 года, когда в статье Sigger с соавт. [24] на результаты опытов H. Takeda было обращено внимание и они были поставлены под сомнение. Но авторский коллектив H. Parkington с соавт., [25] несколько лет спустя признал их доказательными, то есть итоги работы H. Takeda были «реабилитированы». R. Young впервые опубликовал ссылку на работу H. Takeda (1965) лишь в 2011 году в статье «Mechanotransduction in rat myometrium: coordination of contractions of electrically and chemically isolated tissues» [22], которая была им опубликована в журнале Reproductive Sciences совместно с G. Goloman. Сам же H. Takeda после публикации своей статьи в 1965 году представленными в ней проблемами более не занимался и по неизвестным нам причинам перестал сотрудничать с A. Csapo.
В этой публикации Хироши Такеда было представлено необычно много демонстративных доказательных материалов, содержание которых не укладывалось в схему «пейсмекер - потенциал действия – возбуждение – сокращение», и порой находились в ней в серьёзных противоречиях. Авторам очень сложно по этическим причинам комментировать этот, несомненно, гениальный по методологическим и технологическим решениям труд, с содержанием которого удалось познакомиться только в 2013 году, благодаря тому же R. Young, который в том же году предъявил авторам претензии по линии конфликта интересов и, даже пытался выдвинуть обвинения в нарушении авторского права в связи с публикацией работы «О миогенном механизме синхронизации и координации сокращений утеромиоцитов во время родовой схватки человека» в журнале «Journal of Maternal-Fetal and Neonatal Medicine» в 2013 году [26]. Очень быстро выяснилось, что все выдвинутые претензии абсолютно необоснованы. Но эта история позволила глубже изучить работу H. Takeda [23] и предположить, что столь необычная судьба этого исследования могла объясняться тем, что её результаты можно оценить как первый «гвоздь в крышку гроба» уже тогда нежизнеспособной концепции пейсмекерного происхождения потенциала действия, под влиянием которого и должно было, по мнению её сторонников, инициироваться фазное родовое сокращение миометрия.
На рисунке 1 демонстрируются результаты серии опытов на матке экспериментального животного с использованием технологии двух баллонов из работы H. Takeda.
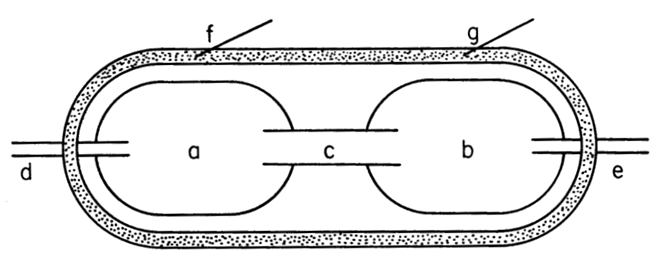
Рисунок 1 (описание в тексте).
В полость матки in situ крольчихи, только что завершившей естественные роды, вводилось два баллона, которые размещались в каждом роге матки. Полости баллонов имели связь с помощью трубки (с). Каждый баллон имел катетер для измерения давления в нём. В каждый рог имплантировался электрод для снятия электромиографии (ЭМГ) (рис 1). После заполнения баллонов жидкостью их объём увеличивал объём рогов матки, т.е. симулировал объём концепта, что приводило к развитию спонтанных схваток (рис 2 А). В модели опытов С оба рога матки подверглись хирургической изоляции, но полости этих баллонов имели прямую гидравлическую связь и рога матки сокращались в синхронном режиме. При прерывании гидравлической связи между рогами матки (опыт В) каждый рог матки сокращался в индивидуальном режиме.
Восстановление гидравлической связи между рогами матки приводило к полной синхронизации их сократительной деятельности.
В своих уникальных опытах на рожающей матки животного in situ H. Takeda [23] неоспоримо и демонстративно показал, что между механическим импульсом, действующим изнутри полости матки, воздействующим как импульс дорастяжения утеромиоцитов мышечной оболочки матки, и механизмами инициации и синхронизации фазного родового сокращения миометрия имеется прямая причинно-следственная связь. Поскольку импульс дорастяжения транслируется гидравлическим содержимым полости матки, то, согласно законам гидродинамики (закон Паскаля), он одновременно и с одинаково силой воздействует на мышечную оболочку матки, вызывая не только одиночное фазное сокращение в каждом сократительном элементе, подвергающемуся эффекту силового дорастяжения, но и побуждает всё сообщество этих элементов демонстрировать синхронизированные генерализованные сокращения всей мышечной оболочки матки.
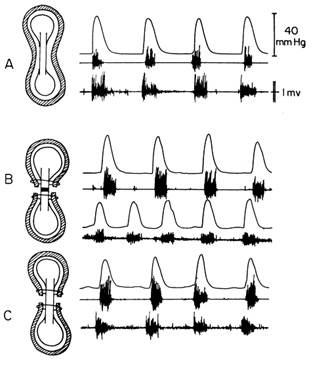
Рисунок 2 (объяснения в тексте)
Авторы статьи полагают, что опыты Хироши Такеда дают основание считать, что инициатором фазного сокращения миометрия является прямое механическое воздействие на утеромиоцит, в котором уже активирована готовность к реализации программы этого фазного сокращения, а регистрируемый с началом сокращения потенциал действия является электрогенным отражением электрохимических процессов, происходящих в миофибриллярном аппарате клетки в момент генерации мышечного натяжения, то есть определяется как вторичное явление.
Эту часть обзора, в которой рассмотрена познавательная, научная и практическая ценность всех до сих пор обсуждаемых в мировой акушерской литературе моделей и механизмов инициации и синхронизации фазных родовых сокращений матки человека, диалектически гармонично можно завершить цитатой из уникального учебника «Акушерство» профессора Н.З. Иванова (1926) стр. 92: цитируем дословно – «…Если бы мы захотели найти где-нибудь прямое ясное описание взаимоотношения и причин всех этих явлений, описание откровенное, то есть с обозначением того, что мы в этом вопросе знаем наверное и что мы только предугадываем, то такого описания нигде, оказывается, нет…».С глубоким сожалением необходимо заключить, что, несмотря на предпринимаемые неоднократные попытки как честных и достоверных научных исследований, так и построения умозрительных конструкций - и в вариантах добросовестного заблуждения, и в вариантах откровенных псевдонаучных спекуляций – спустя почти столетие с прочувствованных слов профессора Иванова Н.З. в современное мировоззрение акушеров так и не внедрена достоверная, применимая в практике научная доктрина родовой деятельности человека!
Ни в одной из обсуждённых выше моделей нет «ясного и откровенного» описания первичного биомеханического события, которое в литературе долгие годы обозначается как «водитель ритма схваток». Все попытки отождествить его с потенциалом действия, исключительная трактовка которого определяет его, как субъекта внешнего воздействие на миометрий, провалились.
Обсуждение. Между тем в 1969 году в авторитетном журнале были опубликованы две статьи V. Brotanek, C.H. Hendricks, T. Yoshida [27,28] посвящённых уже ставшей в те годы модной проблеме изучения особенностей изменения гемодинамики матки во время родовой схватки. Авторы этих публикаций исследовали динамику интенсивности общего маточного кровотока у беременных и рожениц во время фазных сокращений матки.Вот как интерпретировались итоги этого исследования, цитируем: «Интенсивность кровотока в матке начинает снижаться приблизительно за 30 секунд до начала подъема амниотического давления и это продолжающееся снижение кровотока до самого начала подъёма амниотического давления достигает в это время минимальной интенсивности. С началом повышения амниотического давления интенсивность кровотока в матке начинает возрастать. Этот рост интенсивности кровотока продолжается до момента, когда давление в полости матки достигнет отметки 30 мм.рт.ст.. При дальнейшем повышении амниотического давления интенсивность кровотока в матке начинает снижаться и достигает своего минимума на пике схватки или сразу после неё. После этого по мере снижения амниотического давления в фазе расслабления матки интенсивность кровотока в матке продолжает возрастать и достигает своего исходного уровня к концу фазы расслабления».Характерное для эффективной родовой схватки обязательное замедление интенсивности кровотока перед началом схватки авторы назвали «предвестником схватки» и впервые в мире сделали предположение, что это замедление кровотока причинно-следственно связано с процессом инициации фазного родового сокращения матки человека. Несмотря на то, что это характерное для физиологической родовой схватки замедление интенсивности кровотока перед началом подъёма амниотического давления было подтверждено и другими, в том числе отечественными исследователями (А.М. Николаева, 1972) идея связи этого замедления с механизмом инициации родового сокращения матки не получила своего дальнейшего развития.
Между тем в публичном отечественном информационном поле теории родов широко представлена [7,8,9] оригинальная авторская миометрально - гемодинамическая концепция биомеханики родовой схватки человека (А.Г. Савицкий, Г.А. Савицкий) [11,12,13]. В концепции три основных раздела: первый касается миометрально-гемодинамического генеза функционирования «водителя ритма схваток», второй - миометрально-гемодинамического механизма генеза родовых сил и, третий, миометрально-гемодинамического генеза функционирования механизма конвертации энергии фазного родового сокращения миометрия в полезную внешнюю работу по трансформации матки человека в первом периоде родов из органа плодоношения в орган плодоизгнания.
В данном обзоре авторы рассматривают только проблему миометрально-гемодинамического генеза инициации сократительной деятельности матки, которая в профессиональной литературе описывается как понятие о функционировании «водителя ритма схваток - пейсмекера». На рисунке 3 представлена динамика давления в полостях тела и выходного сегмента матки у пациенток с гипо- и нормотоническим течением первого периода родов, полученная с помощью двухканальной внутренней гистерографии по методу профессора В.В. Абрамченко. Полученные данные характеризуют превышение давления в полости нижнего сегмента над внутриматочным давлением на пике схватки, как обязательное свойство физиологической эффективной родовой схватки. При отсутствии этого феномена схватка становится неэффективной. При анализе гистерограмм также следует обратить внимание на факт разницы во времени от момента начала подъёма внутриматочного давления и от момента начала подъёма давления в полости нижнего сегмента – первично подъём начинается в полости матки и лишь потом с некоторой задержкой начинает увеличиваться полостное давление в выходном отделе матки.
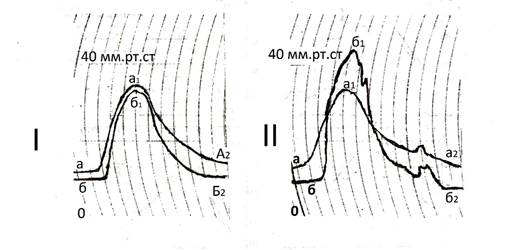
Рисунок 3
I – запись динамики давления в полости матки (а,а1,а2) и в полости нижнего сегмента (б,б1,б2) при гипотонической дисфункции матки. II – динамика тех же показателей давления при физиологическом течении родов.
Таким образом, данные гистерографии свидетельствуют следующее:
· во-первых, каждый функциональный отдел матки в родах (полость матки, полость нижнего сегмента) в определённой степени гидравлической независим;
· во-вторых, сокращение в матке начинается в её теле, что является неоспоримым свидетельством того, что механизмы, инициирующие фазное родовое сокращение матки, локализованы в теле органа.
Согласно закону соответствия структуры и функции механизм, инициирующий родовую схватку, должен быть представлен в теле матки в виде характерного морфоструктурного образования (объекта). Для достижения научной точности и достоверности авторы этой статьи уже давно предпринимали попытки поиска этого объекта. Авторские исследования по функциональной морфологии матки человека [11,12], которые проводились на беременных и рожающих матках человека, отражены в ряде монографии [13,14] и дополнены исследованиями препаратов матки с разнообразными патологическими процессами, при которых наблюдался феномен гипертрофии миометрия [29,30]. Итоги этих исследований схематично отражены на рисунке 4.
Естественно, в силу освещаемых в этом абзаце задач, интерес представляла функциональная морфология только тела рожающей матки человека, в котором, как можно обоснованно полагать, локализуется загадочный «пейсмекер - водитель ритма схваток».
Согласно представлениям авторов данной статьи, наружной физической оболочкой тела матки является компактный мышечный слой с плотно уложенными функциональными сократительными модулями, образующими петлисто-ячеистую структуру. Наружный слой плотно сращён с висцеральной брюшиной и её соединительнотканной подложкой. Эта наружная оболочка тела матки жёстко фиксирована к костям таза круглыми и другими фиксирующими матку связками, которые препятствуют краниальным смещениям тела матки.
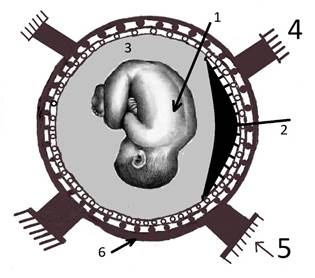
Рисунок 4. Строение тела матки (поперечный срез, вид сверху). Обозначения: 1 – тело плода; 2 – тело плаценты; 3 – амниотическая полость; 4,5 – фиксирующие матку связки; 6 – зона контракционного кольца (срез).
 - наружный мышечный слой
- наружный мышечный слой




 - разделительный венозный синус
- разделительный венозный синус




 - внутренний сосудисто-мышечный слой
- внутренний сосудисто-мышечный слой








 - полость интервиллёзного пространства
- полость интервиллёзного пространства
В области внутреннего анатомического зева функциональные сократительные модули наружной оболочки тела матки вместе с гладкомышечными структурами кардинальных, крестцово - маточных и лонно-пузырных маточных связок образуют особую сфинктероподобную структуру - контракционное кольцо. Участие в его образовании принимают и сократительные модули внутреннего мышечного слоя. Эта структура обладает функцией «удавки» (констрикции) и с начала родов разделяет общую полость плодовместилища на две полости, функциональных в биомеханическом и в гидродинамическом отношении - полость тела матки и полость выходного отдела матки.
Кнутри от наружной оболочки тела матки расположено сосудисто - мышечное образование, названное авторами [7] «разделительным венозным синусом (РВС)». РВС морфологически представлен тонкостенными венозными лакунами различной формы и величины, широко анастомозирующими друг с другом. Лакуны армированы функциональными сократительными модулями, переходящими из слоя в слой и образующими трёхмерную петлисто-ячеистую структуру, напоминающую пчелиные соты. Кнутри от разделительного венозного синуса локализуется второе сосудисто-мышечное образование - внутренней мышечный слой оболочки тела матки, представленный огромным количеством относительно некрупных тонкостенных венозных лакун, анастомозирующих друг с другом. Эти лакуны вмурованы в трёхмерную петлисто-ячеистую структуру функциональных сократительных модулей миометрия. Внутренняя поверхность внутреннего сосудисто-мышечного слоя, плотно морфологически ассоциирована с децидуальной тканью и контактирует с амниотическими оболочками концепта непосредственно. Но на одном участке, в месте локализации плаценты (физически выполняющую биомеханическую роль амниотической оболочки) их разделяет полость интервиллёзного пространства.
Итак, кнутри от физической наружной оболочки тела матки, обладающей собственной полостью, локализованы четыре морфоструктуры, в составе которых есть объёмные полостные образования с жидким несжимаемым содержимым. Три изэтих морфоструктур с точки зрения гидродинамики являются проточными, то есть их объём и объём их несжимаемого субстрата зависит от соотношения объёмных величин притока и оттока жидкости, поступающей в их полости и эксфузируемой из них в каждый данный момент времени. Это:
· полость разделительного венозного синуса;
· полости венозного депо внутреннего мышечного слоя матки;
· полость интервиллёзного пространства.
При этом, согласно законам гидродинамики (гемодинамики) величина объёма этих полостных образований может возрастать одновременно с повышением внутриполостного давления, но, также, может и уменьшаться с одновременным снижением давления в их полостях. Сказанное может быть проиллюстрировано аналоговой виртуальной моделью, представленной на рисунке 5.
То есть функционирование этой модели как гидродинамической системы находится в полном соответствии с действием законов Паскаля и Лапласа и, поскольку она отражает функционирование тела матки как гидродинамической системы, то описываемые выше события могут определять морфофункциональное состояние реально функционирующего органа in vivo. Если рассматривать кинетику и эргономику венозного дренажа рожающей матки человека, то, для стандартных физиологических условий функционирования плодовместилища и концепта (плодоамниотического комплекса) наличие этих гигантских, причудливых, да ещё внутримиометрально локализованных венозных депо РВС и внутреннего мышечного слоя, избыточно и нецелесообразно.
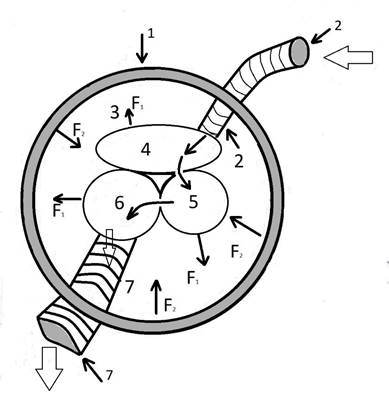
Рисунок 5 (условная схема).
1- физическая наружная оболочка тела матки; 2 – система артериального притока; 3 – амниотическая полость; 4 – полость интервиллёзного пространства; 5 – венозное депо внутреннего мышечного слоя; 6 – разделительный венозный синус; 7 – система венозного оттока. F1 – сила давления, которая возникает при увеличении объёма полостей (закон Паскаля). F2 – тангенциальное напряжение мышечной оболочки тела матки, возникающее в ответ на повышение давления во всех полостных образованиях тела матки (закон Лапласа).
Именно из-за размера (объёма), причудливой ангиоархитектоники и внутримиометральной локализации этих депо резко возрастает показатель внутренней сосудистой резистентности, что обусловливает затруднения венозного дренажа тела матки. При этом сосудистая резистентность этой кровеносной сети находится под полным контролем внутримиометрального давления.А это означает, что чем выше базальный тонус матки, тем выше показатель наружной сосудистой резистентности (зависящей от внесосудистых внешних факторов) и тем выше показатель тотальной сосудистой резистентности. Соответственно и дефицит венозного дренажа (уменьшение объёма венозной крови, оттекающей от матки) становится больше.
В теле матки функционируют два контура кровообращения – миометральный и маточно-плацентарный, на долю последнего приходится 80-85% общего маточного кровотока.
Авторы статьи подтверждают, что с момента начала функционирования системы маточно-плацентарного кровообращения, его возрастающая (по мере увеличения массы плода и миометрия) интенсивность прямо сопряжена с прогрессирующим развитием венозных депо миометрия и увеличением объёма интервиллёзного пространства. Это сопровождается прогрессирующим возрастанием внутренней сосудистой резистентности в системе венозного дренажа тела матки и прогрессирующим дефицитом оттока венозной крови от тела матки по мере возрастания срока беременности. Всё это неизбежно создаёт ситуацию, в которой формула гемо-гидродинамических и биомеханических физических взаимодействий может быть выражена так:
· затруднение венозного дренажа →
· депонирование крови в венозные депо миометрия→
· возрастание объёма венозных депо миометрия→
· подъём внутриполостного давления, которое в определённый момент времени приводит к появлению давления, оказывающего механическое воздействие на мышечную оболочку тела матки.
Механическое воздействие на миоциты приводит к активации одного из их важнейших фундаментальных свойств – свойства рецептора растяжения, что приводит к активации одиночного фазного сокращения миометрия. Это единственный безопасный и целесообразный с точки зрения законов природы выход из этого положения - повышение внутриамниотического давления, что приводит к неизбежной эксфузии крови из венозного депо миометрия наружу по градиенту давления.Повышение амниотического давления в этой ситуации может осуществляться только повышением тангенциального напряжения миометрия, которое и обусловливает появление градиента давления в пользу амниотической полости. Для этого природа и создала большое генерализованное маточное сокращение во время беременности, которое мы называем схватками Брекстона Хикса (Braxton Hicks). Следовательно, как ясно из вышеизложенного, во время беременности миометрий мышечной оболочки тела матки сохраняет способность реагировать на силовые воздействия, исходящие из полости тела матки,одиночным фазным сокращением, с помощью которого из венозного депо миометрия в течение нескольких десятков секунд эксфузируется в общий кровоток примерно 350 мл (270-550 мл) крови [7,9,13]. Таким образом, на протяжении, как минимум, второй половины беременности на принципах саморегуляции функционирует своеобразное «миометральное сердце», с помощью сокращений которого сохраняется и поддерживается физиологическое функционирование в первую очередь маточно-плацентарного контура кровообращения.
Проведённые авторами исследования фундаментальных механических свойств миометрия беременной и рожающей матки человека подтвердили, что миометрий мышечной оболочки матки всегда сохраняет уникальную способность генерации отдельного фазного сокращения при воздействии на него силового механического импульса, оказывающего на миометрий эффект дорастяжения [7,9,13]. При изучении особенностей сократительной деятельности миометрия рожающей матки человека, с использованием, в том числе, уникальных модельных экспериментов [13,29,30], было выявлено, что в этой высокоспециализированной гладкомышечной ткани в геноме утеромиоцитов эволюционно закреплены особые фундаментальные механические свойства. Так установлена способность к развитию как отдельных фазных сокращений, так и особые свойства, позволяющие длительное время генерировать фазные сокращения в варианте ауторитмики. Соответственно, утеромиоциту присущи свойства очень чувствительного механического рецептора растяжения, встроенного в уникальную сократительную систему утеромиоцитов, что позволяет функционировать особому механорецепторному механизму обратной связи по растяжению, вследствие чего миометрий обретает способность адекватного силового реагирования при воздействии на его сократительные элементы стороннего механического воздействия.
Следует отметить свойства миометрия поддерживать определённую степень тонического напряжения и мгновенно реагировать в состоянии физиологического растяжения на укорочение длины клетки с необратимой фиксацией меньшей длины. Все фундаментальные механические свойства утеромиоцитов миометрия рожающей матки человека проявляются только в том случае, если миометрий подвергается вариантам физиологического или патологического воздействия, приводящего к растяжению мышечных клеток. Даже при кратковременных воздействиях, не приводящих к увеличению длины миометрия, связанных с приложением механической силы импульсного характера по оси утеромиоцита, уже при минимальном значении эта сила вызывает реакцию его механорецепторного аппарата. Особое внимание надо обратить на то, что все фундаментальные механические свойства утеромиоцита проявляются параметрически полноценно только при степени растяжения ровно в два раза больше исходной длины (2L0) [7,9,30].Эта длина 2L0 фиксируется с ранних сроков беременности и прецизионно сохраняется в течение роста матки благодаря синхронизации с процессом гипертрофии покоя мышечных клеток.
Благодаря, например, использованию авторами уникальной модели опыта с двумя изолированными полосками миометрия, помещёнными в отдельные перфузионные камеры и соединенными между собой только механической связью (рисунок 6), впервые удалось выявить и документировать генерацию ряда биомеханических феноменов, имеющих прямое отношение к инициации как отдельного фазного сокращения миометрия, так и фазной ауторитмики, а также их особенностей.
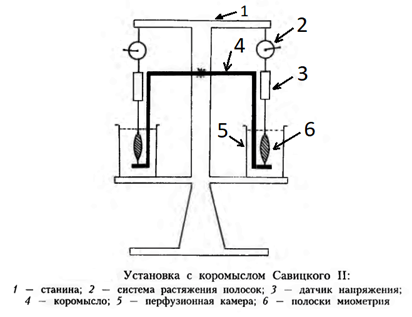
Рисунок 6
Авторам удалось показать фундаментально значимые особенности взаимозависимых и взаимообусловленных отношений двух сократительных систем миометрия, имеющих между собой прямую механическую связь. А главное, что удалось доказать, что эта взаимообусловленность определяется наличием в каждой из этих систем (полосок) равноценных способностей как генерировать механический сигнал, биомеханически проявляющийся в соседней полоске, как импульс дорастяжения, так и мгновенно реагировать на этот импульс адекватной зеркальной механической реакцией сопротивления (рисунок 7). Наличие этих свойств присутствует в каждом структурном элементе миометрия, начиная от утеромиоцита и функционального сократительного модуля и вплоть до всей мышечной оболочки тела рожающей матки. Существование здесь прямой механической связи, в том числе и обусловленной гидродинамически, превращает мышечную оболочку тела матки в монолитную биомеханическую систему, способную адекватно реагировать на любой механический импульс дорастяжения, независимо от его природы.
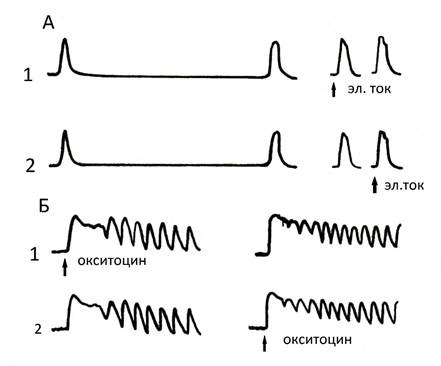
Рисунок 7
Опыт, демонстрирующий одинаковые синхронизированные сокращения полосок миометрия при использовании установки с коромыслом Савицкого II воздействии электрического сигнала попеременно на полоску 1 и 2 (опыт А). В опыте Б отражена реакция полосок миометрия на окситоцин при его изолированном действии на полоску 1 и полоску 2.
Предположения об эмерджентности (приобретение нового качества целого при объединении более простых и отличных от целого качеств частей) работы матки, которые сейчас популярны у западных учёных [4,31,32], пока доказательной базы так и не получили.
Опыты авторов на установке с коромыслом Савицкого II (рис.6) позволили установить, что на короткий мгновенный механический импульс дорастяжения миометрий, растянутый до 2L0, реагирует одиночным, стандартным в параметрическом отношении фазным сокращением. На, действующие относительно продолжительно во времени с колеблющейся характеристикой силового воздействия, импульсы дорастяжения миометрий реагирует адекватной зеркальной механической контракцией (рис. 7). Таким образом, согласно представленным авторами данным, которые за всё время их фигурирования в публичном информационном поле теории родов (уже более 40 лет) никем не были опровергнуты и их достоверность даже не была подвергнута обоснованным сомнениям, можно утверждать, что в рожающей матке человека действительно функционируют две морфофункциональные системы:
· гемодинамическая, способная генерировать силовые импульсы растяжения, которые транслируются на миометрий гидродинамически;
· миометральная, способная реагировать на этот импульс дорастяжения генерацией одиночного фазного родового сокращения матки.
И самое замечательное состоит в том, что одно из фундаментальных механических свойств миометрия, а именно, способность поддерживать тоническое напряжение мышечной оболочки матки на определённом уровне (базальный тонус) является средством, определяющим частоту генерации импульсов дорастяжения в гемодинамической системе матки, то есть является механизмом определения частотных характеристик фазной ауторитмики (родовых схваток).
Клинические наблюдения, подкреплённые данными внутренней гистерографии, свидетельствуют о том, что механизм, инициирующий родовые сокращения матки человека срабатывает в теле матки либо к концу паузы между схватками, либо при физиологическом течении родов в самом конце заключительной фазы диастолы, то есть в тот момент, когда миометрий находится в состоянии минимальной величины линейного натяжения (базального тонуса). На рисунке 8 схематично отражены итоги посекционного хронометрического анализа событий, происходящих в гемодинамической системе матки во время физиологической родовой схватки.Дифференциал давлений в амниотической полости и полости интервиллёзного пространства во время фазного родового сокращения матки человека впервые был изучен C. Hendricks ещё в 1959 году [33]. Дифференциал давлений в конкретной ситуации даёт возможность не только судить об абсолютной величине давления в полости амниона и интервиллёзном пространстве в каждый данный момент родового сокращения матки, но и при его инверсии в пользу интервиллёзного пространства, является абсолютно объективным доказательством того, что в этот момент объём хориодецидуального пространства начал процесс своего силового увеличения.Увеличение объёма интервиллёзного пространства связано с возрастанием давления в нем. И, хотя, величина перфузионного давления в интервиллёзном пространстве невелика, превышение давления в нём величины давления в амниотической полости всего на 1 мм.рт.ст. создаёт силу давления на плодовую часть плаценты суммарной силой ≈ 400 г. [9,13, 14].Гидравлическое содержимое амниотической полости транслирует этот силовой импульс на всю поверхность мышечной оболочки тела матки с силой примерно 1,3 г/см2.
На схеме (рис. 8) можно отследить динамику всех гидродинамических (гемодинамических) событий, которые происходили в каждый конкретный момент сократительного маточного цикла. Первое, что необходимо зафиксировать - из миометрального контура кровообращения в венозное депо миометрия каждую секунду, независимо от фазы сократительного цикла, сбрасывается ≈ 1,5-1,8 мл/сек венозной крови под давлением, всегда превышающим давление в толще миометрия.
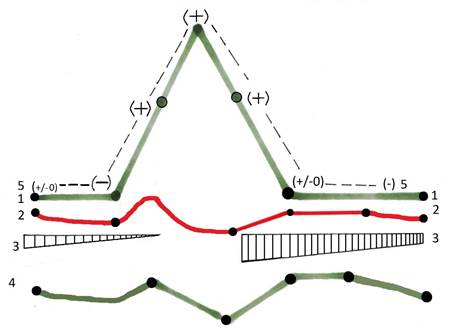
Рисунок 8
Обозначения: 1 - динамика внутриполостного давления в теле матки; 2 - скорость объёмного кровотока в хориодецидуальном пространстве; 3 - динамика венозного дренажа тела матки; 4 - динамика общего кровотока в теле матки; 5 - динамика величины дифференциала давления в амниотической полости (+ a) и интервиллёзном пространстве (- b) (Diff P = +aP – bP).
Интенсивность артериального притока, которая достигает максимума к моменту завершения фазы расслабления, примерно за 30 секунд до подъёма амниотического давления начинает снижаться и это снижение по одним данным продолжается и достигает минимума к отметке амниотического давления, равной 30 мм.рт.ст., но в первой фазе диастолы схватки, после чего начинает вновь возрастать и достигает исходных величин либо к концу фазы диастолы, либо в начальных отделах паузы между схватками. По другим данным артериальный приток в хориодецидуальном пространстве с началом подъёма амниотического давления возрастает, но, после достижения отметки амниотического давления в систоле схватки 30 мм.рт.ст., начинает снижаться, и его дальнейшая динамика происходит по «первому варианту».
Динамика общего маточного кровотока (4) совпадает по особенностям её девиаций со вторым вариантом динамики кровотока в хориодецидуальном пространстве. Уникальны изменения венозного дренажа тела матки во время физиологической родовой схватки. Напомним, что роды начинаются с повышения базального тонуса матки, приблизительно в два раза с 4-6 мм.рт.ст. до 8-12 мм.рт.ст., что значительно увеличивает показатель тотальной сосудистой резистентности системы венозного дренажа тела матки и, естественно, увеличивает величину его дефицита, то есть уменьшается и затрудняетсяотток венозной крови из матки.
Центральным событием является факт полной блокировки венозного дренажа тела матки после того, как амниотическое давление во время схватки превысит отметку в 30 мм.рт.ст., то есть на протяжении второй фазы систолы и первой фазы диастолы схватки венозная кровь из органа не эксфузируется. Она депонируется в венозных депо миометрия и в хориодецидуальном пространстве. После снижения амниотического давления ниже 30 мм.рт.ст. в начале второй фазы диастолы венозная кровь из венозных депо миометрия начинает интенсивно сбрасываться в систему маточных вен по закону объёмного кровотока Q = ΔP/R (где ΔP – разница давлений на входе и выходе, а R – сосудистое сопротивление). Именно большая разность давлений обусловливает высокую скорость и, соответственно, значительный объём сбрасываемой венозной крови. Интенсивность венозного дренажа по мере снижения амниотического давления начинает анахронно снижаться и это снижение продолжается до момента конца очередной родовой схватки.
Динамика дифференциала давления (+ a – b) на всём протяжении систолы и диастолы схватки имеет знак (+), то есть давление в полости амниона на протяжении сократительного цикла остаётся более высоким, чем давление в полости интервиллёзного пространства - оно на пике схватки достигает в среднем величины дифференциала ≈ 2,6 мм.рт.ст.. В начальной (постдиастолической) фазе паузы, то есть при достижении уровня базального тонуса матки, дифференциал давления нивелируется (± 0). Но примерно за 30 секунд до начала систолы он инверсируется в пользу давления в интервиллёзном пространстве (-) и достигает величины близкой к минус 1-2 мм.рт.ст..
Таким образом - какие гидродинамические, гемодинамические и биомеханические события происходят в теле рожающей матки человека в заключительной части паузы между схваток, непосредственно предшествующие началу фазного сокращения органа при физиологическом течении первого периода родов? Итак, возьмём в течение этой части паузы мгновение X, в котором совершается переход миометрия из одного функционального состояния в другое. Инициатором этого перехода является силовой импульс дорастяжения, который к этому мгновению X достигает необходимой для инициации схватки силы воздействия на мышцу. Если по судить по результатам наших опытов с использованием коромысла Савицкого I (рис. 9), то и сама продолжительность мгновения X, и величина импульса дорастяжения, транслируемая по коромыслу, очевидно, очень малы [9,13,14].
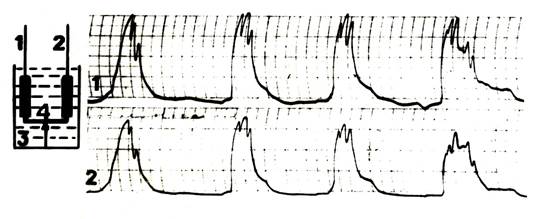
Рисунок 9 (объяснение в тексте)
Следовательно, чувствительность сенсорных механизмов механорецепторного механизма обратной связи по растяжению - организатора фазного сокращения миометрия, настолько велика, что позволяет инициировать процесс фазного сокращения активированного в родах миометрия при неких критических минимальных значениях силового воздействия на миометрий импульса дорастяжения, который генерируется в гемодинамической системе матки к началу мгновения X. Уникальность гемодинамических, гидродинамических и биомеханических событий, развивающихся в гемодинамической системе матки в момент Х состоит в следующем:
· артериальный приток в муральной системе миометрия и в маточно-плацентарном контуре кровообращения в этот момент времени достигает своего максимума;
· венозный, наружный дренаж, то есть сбрасывание венозной крови за пределы органа, к этому времени в покоящемся миометрии достигает своего минимума. Следовательно, большая часть артериальной крови, инфузируемой в интервиллёзное пространство и сосудистые депо миометрия в этот момент депонируется и начинает влиять на величину объёма и интервиллёзного пространства, и венозных депо миометрия.
Прямыми признаками начинающегося процесса депонирования крови в эти сосудистые образования является инверсия дифференциала давления в пользу интервиллёзного пространства и снижение объемного общего кровотока матки. Именно к мгновению X феномен силового депонирования крови в сосудистые депо миометрия и интервиллёзного пространства и достигает той величины, которая в виде импульса дорастяжения инициирует очередное фазное сокращение миометрия тела рожающей матки человека. При этом самым замечательным обстоятельством является то, что полный контроль за частотой генерации импульса дорастяжения миометрия и, следовательно, частотой генерации фазных родовых сокращений матки связан с величиной базального тонуса матки. Чем выше базальный тонус миометрия, тем чаще генерируются фазные сокращения органа.
Время показало, что все попытки, в которых участвовали такие авторитеты как R. Caldeyro-Barcia, A. Csapo, C. Wolfs [6,15,16] и, в последнее время, R. Young [19,21,22], раскрыть тайны механизма инициации родового фазного сокращения миометрия матки человека на основе догматов доктрины пейсмейкера и потенциала действия оказались безуспешными, а само направление исследования неосознанно тупиковым. Миометрально - гемодинамическая концепция биомеханического существа механизма инициации родового сокращения матки человека, предложенная авторами данной статьи, построена на альтернативных концепции потенциала действия идеологических и методологических основах. Она выстраивалась на проверенных и легко проверяемых научно обоснованных и документально подтверждённых клинических, морфологических и экспериментальных данных. Концепция декларирует, что в рожающей матке человека действительно функционирует особого рода миометрально - гемодинамический механизм, который, если угодно проводить понятные аналогии, и выполняет роль пресловутого «пейсмекера - водителя ритма». И одно из главных её отличий от официальных шор нейрогенно-гибридной теории родовой схватки [34,35,36] – это понимание того, что рождение импульса, приводящего к развитию фазного сокращения матки, является следствием активации внутренних фундаментальных свойств утеромиоцитов, а не привлечение внешнего по отношению к ним потенциала действия, как в генерализованном градиентном или деформационно - волновом варианте, так и в варианте в большей или меньшей степени очаговой механотрансдукции (варианты зонального дробления «пейсмекера», «двойная модель»). Нельзя сказать, что исследования нарушений сократительной деятельности матки не проводятся отечественными учёными [37,38,39], некоторые работы даже весьма оригинальны и методически обеспечены [40,41,42], однако большинство [43,44,45] носит клинико-статистический характер. Отечественные учебные [46,47] и учебно-методические ресурсы содержат только описание теорий, опирающихся на положения пейсмекерно-волновых и пейсмекерно-нейрогенных представлений об активации и синхронизации сокращений миометрия в родах [48,49]. К сожалению, в этих информационных ресурсах никак не представлены и никак не обсуждаются альтернативные взгляды на биомеханику родовой деятельности человека, которые, на самом деле, в информационном поле современного акушерства достаточно широко представлены и оформлены [50].
Заключение. Миометрально-гемодинамическая концепция позволила авторам данной статьи создать новый вариант понимания проблемы, связанный с понятием гипертонической дисфункции матки человека в родах (ГДМ). Представления о ГДМ прошли к настоящему времени позитивную апробацию в практическом родовспоможении, получили авторскую клиническую классификацию и давно представлены для объективного и конструктивного обсуждения отечественной акушерско-гинекологической общественности. Это обсуждение необходимо не только в планеобщепринятой рутинной процедуры анализа новых тенденций развития науки, но и в связи с тем, что в ряде акушерских проблем, связанных именно с вопросами активации и регуляции родовой деятельности, не только не наблюдается реального прогресса, но всё более очевидно проявляется стагнация и безыдейность (например, при решении проблем преждевременных родов).
Библиографическая ссылка
Савицкий А.Г. О МЕХАНИЗМЕ ИНИЦИАЦИИ РОДОВОГО СОКРАЩЕНИЯ МИОМЕТРИЯ МАТКИ ЧЕЛОВЕКА ИЛИ О «ПЕЙСМЕКЕРЕ – ВОДИТЕЛЕ РИТМА СХВАТОК» // Научное обозрение. Фундаментальные и прикладные исследования. 2025. № 1. ;URL: https://scientificreview.ru/ru/article/view?id=125 (дата обращения: 25.12.2025).
