Актуальность. По данным ВОЗ, в структуре рака кожи меланома составляет 1%, занимая первое место по смертности. За последние 40 лет заболевание меланомой увеличилось в 15 раз. По данным American Cancer Society медиана выживаемости при меланоме пропорциональна стадии заболевания и метастазированию опухоли в отдалённые участки кожных покровов, отдалённые лимфоузлы, но не в другие органы. Узловая меланома является наиболее агрессивным типом опухолей кожи, характеризуется ранним метастазированием в лимфоузлы, лёгкие, печень, головной мозг, кости.
Метастазы, очаги малигнизации, развивающиеся на расстоянии от первичной опухоли, являются причиной смерти 90% пациентов, умерших от рака [1]. На протяжении столетия процесс метастазирования объяснялся в рамках приоритетной концепции малигнизации клеток, или теории соматических мутаций (SMT). Доказательство несостоятельности этого постулата о том, что рак является проблемой нерегулируемой пролиферации клеток, а малигнизация обусловлена частичной хромосомной перестройкой вследствие реакции на ее окружение, сменилось концепцией отсутствия апоптоза в аномальных клетках и теорией TOFT (Tissue Organization Field Theory). Ошибочные восприятия способствовали развитию представлений об «онкогенах», не имеющих биологической реальности, явившихся креационизмом в биологии. Молекулярно генетические исследования показали отсутствие вирусной ДНК в малигнизирующихся клетках. Апоптоз аномальных клеток свидетельствует о несостоятельности мутационной концепции рака. Безуспешность терапевтических подходов, основанных на тупиковых теориях, требует исследований в направлении поиска доказательств реальных механизмов канцерогенеза, изучения природы и свойств раковых клеток и сущности метастазирования [2]. Существуют большие трудности в дифференциальной диагностике меланомы от доброкачественных или злокачественных кожных новообразований [3]. Часто метастазы обнаруживаются раньше первичной опухоли, что не вписывается в рамки концепции формирования метастазов из пула клеток мигрантов из первичной опухоли. Несмотря на активные исследования динамики миграции раковых клеток, понимание процесса метастазирования остаётся противоречивым [4, 5, 6]. Признаны два cпособа миграции опухолевых клеток, утративших связь с первичной опухолью, в другие органы: гематогенным и лимфогенным путями. Считают, что дозорный статус лимфатических узлов является сильным прогностическим фактором при меланоме [7]. Однако, отмечено, что при динамическом наблюдении у 21% лимфоузел-отрицательных пациентов развиваются отдаленные метастазы [8, 9]. Отсюда следует несостоятельность теории миграции раковых клеток из первичных опухолей в современной теории канцерогенеза. Наличие огромного количества данных по метастазам меланомы, собранных из различных органов, требует дополнительного анализа и решения вопроса, действительно ли раковые стволовые клетки (CSC) инициируют и поддерживают метастатический потенциал, избегая иммунобиологического надзора.
Целью исследования явилось установление морфологических особенностей метастазов меланомы в печени, почке, лёгких – органах, подвергающихся отдалённому метастазированию. Наши исследования были направлены на анализ гистологических подтипов метастазов по сравнению с первичной опухолью.
В связи с этим решались задачи провести сравнительный анализ особенностей строения первичной опухоли и метастазов меланомы в различных органах.
Материал и методы Исследования проведены на пациентах онкологической поликлиники г. Владивостока в соответствии с требованиями Минздравмедпрома РФ от 29.04.94 № 82 и согласно номенклатуре клинических лабораторных исследований МЗ РФ (приказ № 64 от 21.02.2000 г.) с учётом положений Хельсинской декларации (2013). В работе использован трупный материал лёгких, почек, кожи, печени, тонкого кишечника, простаты и надпочечников пациентов с метастазами меланомы. С помощью кластерного анализа исследованы потенциальные однородные подгруппы дермального и внутриорганного поражения метастазами меланомы в соответствии с принципами доказательной медицины. Использован классический морфологический метод исследования с окрашиванием срезов гематоксилином и эозином с последующим анализом полученного иллюстративного материала. Ретроспективная оценка поражений проводилась по морфологическим признакам, наблюдавшимся при использовании микроскопа Olympus Bx 52. Исследование проведено с разрешения Этического комитета ФГАОУ ВО ДВФУ.
Морфологические особенности первичной опухоли и метастазов рассматривались по наличию изменений в структуре эпидермиса и дермы, печени и почек, надпочечника, простаты и стенки тонкого кишечника, степени васкуляризации, топографии и количества лимфоцитов и меланоцитов в просвете сосудов и располагающихся перивазально, содержания недифференцированных клеток в поле зрения на срезах, по составу клеточных ансамблей опухолевых инфильтратов, степени целостности эндотелия сосудов.
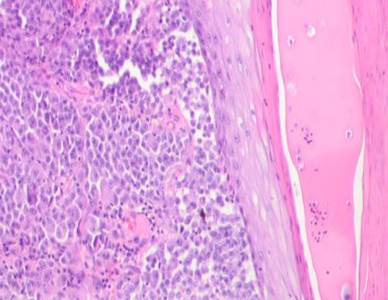
Результаты и их обсуждение. Нами был изучен материал пациентов с диагнозом узловой меланомы на стадии TN1М1b в соответствии с международной классификацией меланом по системе TNM 1997 года. Особое внимание уделяли морфологическим изменениям в структуре кожи, связанным с программированной гибелью кератиноцитов, степени нарушения контактов в структуре эпидермиса, инфильтрации эпидермиса и дермы, а также опухолевой инвазии вглубь кожи с учетом коэффициентов малигнизации по Кларку и Бреслоу. Кроме этого были рассмотрены морфологические особенности элементов микроциркуляторного русла. Под малым увеличением микроскопа на препарате со срезами меланомы виден неравномерный слой утолщенного эпидермиса с обильным лимфоцитарным инфильтратом, распложенным под эпидермисом в виде яркой сплошной полоски, что отражает характерные диагностические признакиля микроинвазии опухоли в дерму. Опухолевые меланоциты, единичные или в виде небольших групп, инфильтрируют все слои эпидермиса. Характерным для меланомы является отсутствие кожного рисунка на поверхности малигнизирующейся кожи (рис. 1, 2).
 а
а
 б
б 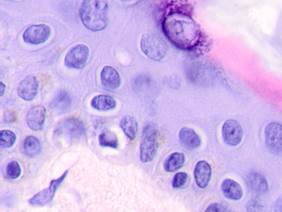 в
в
Рис. 1.Узловая меланома. Деструкция эпидермиса. Отсутствие кожного рисунка на поверхности меланомы. А) поверхность опухоли; б, в) ткань на границе опухоли. Окраска гематоксилином и эозином. Микрофото. Ув. а) х100; б, в) х400.
 а
а 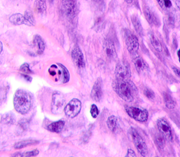 б
б 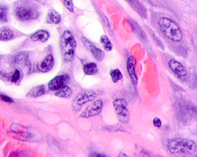 в
в
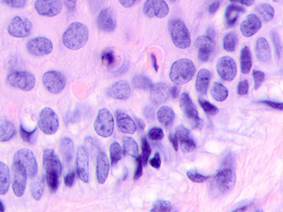
Рис. 2. Меланома кожи. Рост сосудов, апоптоз кератиноцитов, утрата межклеточных контактов в базальных слоях эпидермиса. Окраска гематоксилином и эозином. Микрофото. Ув. х400.
После операции у пациентов через 2 месяца увеличились лимфатические узлы, обнаружились метастазы печени и костей. Компоненты метастазов наблюдались и в лимфатических узлах, а также были повышены опухолевые маркеры, такие как ProGRP и nse. Пациентам была проведена комбинированная химиотерапия с цисплатином и этопозидом (ЭП). Всего больными получено 6 курсов химиотерапии. Через 4,5 месяцев после заключительного курса EP-химиотерапии клиника онкопатологии у всех пациентов восстановилась, появились метастазы в удаленных от опухоли органах. Морфологические особенности первичной опухоли и метастазов рассматривались по наличию изменений в структуре эпидермиса и дермы, печени, почек, надпочечника, простаты, лёгких и стенки тонкого кишечника. Была рассмотрена степень деструкции ткани органов, сопровождающая процесс инфильтрации ткани раковыми метастазами. При морфологической характеристике состава клеточных ансамблей опухолевых инфильтратов, степени целостности эндотелия сосудов было отмечено, что метастазы вызвали атрофию и некротические изменения в предсуществующей ткани. Выявлены патологические изменения в виде кальцификатов и склероза во всех органах. В печени отмечены стеатоз, цирроз и очаги некроза, идентифицировались подобные меланоцитам клетки.
В клинической картине было отмечено, что морфологические изменения привели к последующей утрате функции тканей исследуемых нами органов. В составе клеточных ансамблей метастазов во всех образцах обнаруживались меланоциты (рис. 3).
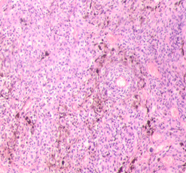 а
а 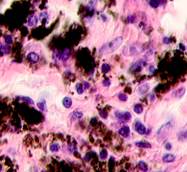 б
б 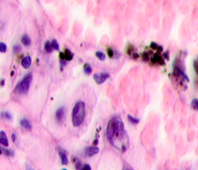 в
в
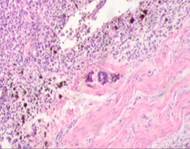 г
г 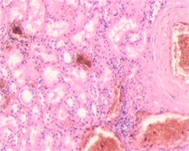 д
д 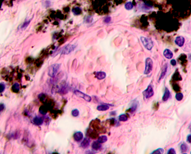 е
е
Рис. 3. Метастазы меланомы кожи а, б) в печень; в) надпочечник; г) простату; д, е) почку. Окраска гематоксилином и эозином. Ув. а, г, д) х100; б, в, е) х400.
Стандартное лечение в случаях ранней диагностики меланомы хирургическое, оно имеет более низкую частоту метастазирования лимфатических узлов, но происходит отдаленное метастазирование, как предполагают, гематогенным способом через кровеносные сосуды. Этот вариант наблюдается чаще всего [10]. Статистика свидетельствует о низкой эффективности системной химиотерапии при меланоме с метастатическими осложнениями.
Известно, что метастазирование и инвазия являются основными признаками прогрессии опухоли и неблагоприятного прогноза не только при меланоме, но и при любом канцерогенезе. Инвазивный рост сопровождается миграцией опухолевых клеток с распространением сквозь тканевые барьеры. Опухоль начинает прорастать в соседние ткани вследствие биохимических и генетических изменений, развивающихся в клетках опухоли. Несомненным признаком злокачественности опухоли является инвазия клеток за пределы органа, попадание клеток в лимфоузлы и кровеносные сосуды, а также рост по периневральным щелям – инвазивный рак. Такой вид рака характеризуется достаточно быстрым ростом, способностью к диссеминации и метастазированию, инвазией опухолевых клеток в прилегающие органы. Идентифицируется распространение инвазивного рака по перисосудистым пространствам, вокруг лимфатических сосудов.
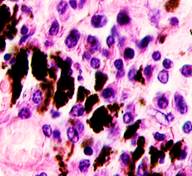
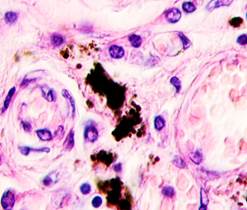
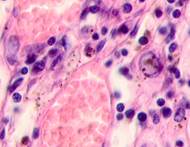
Нами отмечено, что во всех случаях метастазов меланомы пигментные клетки идентифицируются в паренхиме всех исследуемых органов, вокруг кровеносных сосудов (рис. 4).
 а
а 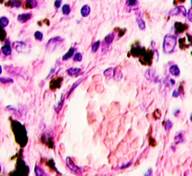 б
б 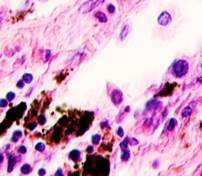 в
в
 г
г 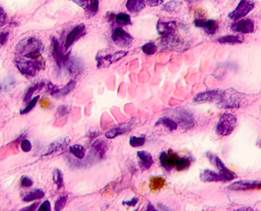 д
д
 е
е 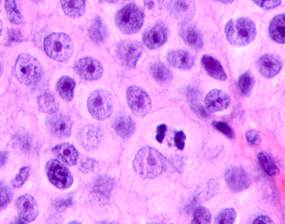 ж
ж
Рис. 4. Пигментные клетки а) в паренхиме печени; б, в, г, д, е) расположенные периартериально; ж) фигуры митоза в гепатоцитах на границе метастазов. Окраска гематоксилином и эозином. Ув. х400.
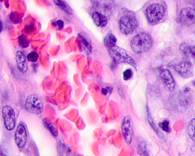
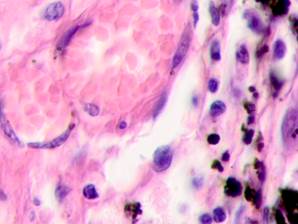
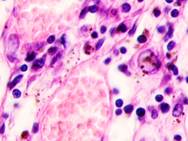
Утрачивается балочная структура печени, дольчатое строение не идентифицируется. Наблюдаются митозы и амитозы (рис. 4 ж). Появление пигментных клеток в составе органа, удаленного от первичной опухоли меланомы, можно рассматривать как начальный регенеративный акт элементов соединительной ткани органа в ответ на атрофические изменения паренхимы. Отсутствие пигментных клеток или макрофагов, содержащих в своей цитоплазме гранулы пигмента, свидетельствует о местной дифференцировке соединительнотканных клеток в пигментосодержащие клетки. Кроме этого, в составе метастазов содержатся инфильтраты, состоящие из клеток, морфологически соответствующих лимфоидному ряду. Такие инфильтраты могут служить выражением экстрамедуллярных процессов кроветворения [11]. Появление лимфоцитарно-плазматических инфильтратов является результатом процесса секреции антител плазматическими клетками, предшественниками которых являются В-лимфоциты, при участии макрофагов (рис. 5).
 а
а 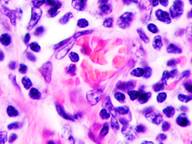 б
б 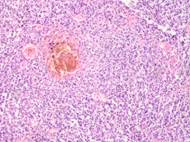 в
в
Рис. 5. Метастазы а) надпочечник; б) кожа; в) печень. Инфильтрат. Окраска гематоксилином и эозином. Микрофото. Ув. а, б) х400; в) х100.
Метастазы меланомы на коже могут быть темно-синего, черного, иногда розового цвета, склонны к быстрому росту, изъязвлению и распаду и консервативному лечению практически не поддаются. Метастазы в коже также характеризуются ещё и тем, что бывают разного цвета и консистенции.
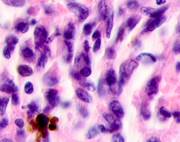
Клетки инфильтрата в органах, удаленных от первичной опухоли, идентифицируются не только в паренхиме, но и в просвете кровеносных сосудов (рис. 6).
 а
а 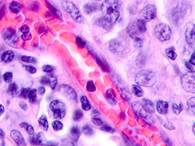 б
б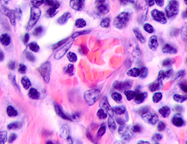 в
в
 г
г 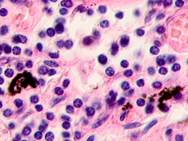 д
д 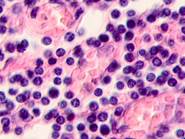 е
е
Рис. 6. Метастазы а) надпочечник; б) кожа; в) печень. Инфильтрат. Окраска гематоксилином и эозином. Микрофото. Ув. а, б) х400; в) х100.
Анализ результатов нашего исследования морфологии опухоли и метастазов позволил установить, что в зоне малигнизации, соответствующей первичной опухоли, идет изменение структуры кожи с нарушением функции, инфильтрат распространяется в дерме. Закономерно возникает вопрос о том, с чем связано появление пигментных клеток в органах, удаленных от первичной опухоли. На основании того, что пигментные клетки в просвете кровеносных сосудов не идентифицируются, мы сделали предположение, что может быть два варианта для объяснения этого явления. Первый связан с тем, что клетки, содержащие пигмент в цитоплазме, являются местными, но получили неправильный сигнал для дифференцировки в меланоциты и к секреции и накоплению пигмента. Второй вариант предполагает, что это пришлые клетки, являющиеся прекурсорными, получившими программу развития и дифференцировки в направлении меланоцитов. Второй вариант предполагает более сложный путь развития, связанный с сигнальной индукцией миграции меланобластов, что требует дополнительного подтверждения, а затем с дифференцировкой меланобластов в меланоциты. Клетки инфильтрата опухоли идентифицируются как в просвете сосудов, так и вокруг сосудов, поэтому не исключается их миграция из первичной опухоли. Противоречит этому только отсутствие иногда первичной опухоли, метастазирование, минующее регионарные лимфатические узлы, быстрое развитие генерализованного метастазирования.
Нарушение функции органов характеризуется клинической картиной в зависимости от степени малигнизации органа. Проблемы метастазов в печени связаны не только со сдавливанием желчных протоков и нижней полой вены. Клинически у пациентов отмечается боль в верхнем подреберье, развитие острой желтухи и образование хронических отеков нижних конечностей, небольшие злокачественные островки деструкции легких. Метастатический рак почти не поддаётся полноценному излечению. На стадии формирования вторичных злокачественных очагов возможна только паллиативная и симптоматическая терапия, призванная продлить жизнь больного и улучшить её качество. Поэтому знание механизмов метастазирования позволит решить проблему профилактики этого грозного осложнения и разработать патогенетически обоснованные методы профилактики. Вторичные опухолевые узлы в кишечнике могут быть результатом рака печени, почек, поджелудочной железы, непосредственно кишечника и многих других онкологических заболеваний. Хирургическое лечение редко применяется на стадии метастазирования, но иногда операции могут быть выполнены с целью восстановления жизненно важных функций органа [12]. В остальных случаях применяют лучевую терапию, химиотерапию, симптоматическое лечение обезболивающими препаратами.
С ростом количества клеток в метастазах, в них начинают формироваться собственные системы кровоснабжения, что ведет к истощению организма вследствие перераспределения питательных веществ и кислорода в пользу вторичных очагов малигнизации. Это связано с кахексией и вторичным иммунодефицитом, наблюдаемых при раках любой локализации.
Средняя продолжительность жизни больных с метастазами в различные органы зависит от локализации: в печени – 6 месяцев, с метастазами в костной ткани при полноценном лечении – несколько лет, с метастазами в почках – от года до 3 лет, с метастазами в головном мозге – несколько недель.
Обсуждение. Результаты хирургического лечения при меланоме не являются гарантией полного излечения пациентов. Вопросы метастазирования первичных опухолей и установление причин способности к инвазии опухолевой клетки не только меланомы, но и других канцерогенезов, требуют разрешения этих вопросов. Вопрос истинных мишеней для консервативного лечения опухолей ждет своего решения. Поиск сигнальных молекул, индукторов дифференцировки и миграции клеток, на современном этапе является наиболее перспективным. Повышения эффективности хирургического метода лечения онкологических заболеваний можно добиться только при подавлении способности к инвазии раковых клеток, воздействуя на эти молекулы лекарственными средствами до и после операции. Пока не будет окончательно доказана природа раковых клеток, создание вакцин на основе дендритных клеток, экстракты из эмбриональных тканей и лекарственных препаратов к белкам-маркерам и генам-маркерам опухолевых клеток будет затруднительным.
Выводы Терапевтическая стратегия, основанная на правильном представлении процессов метастазирования и оценке того, какой клеточный компонент вызвал метастаз, важна в разработке методов патогенетически обоснованного лечения первичных и метастатических опухолей. Изучение процессов индукции на дифференцировку плюрипотентных клеток, как в первичных опухолях, так и в метастатических, лежит в основе выяснения механизмов малигнизации.
Работа выполнена при поддержке Научного фонда ДВФУ, в рамках государственного задания 17.5740/2017/6.7.
This work was supported by Science Foundation Far Eastern Federal University, in the framework of the state task from 17.5740/2017/6.7.
